26-02-2026 14:33:24 pm
বিজ্ঞান - Bigyan
বাংলা ভাষায় বিজ্ঞান জনপ্রিয়করণের এক বৈদ্যুতিন মাধ্যম
An online Bengali Popular Science magazine
https://bigyan.org.in
জীবাণুদের কীভাবে দেখা যায়
Link: https://bigyan.org.in/how-to-see-microbes
অমলেশ (বিজ্ঞান):নমস্কার। আমার সঙ্গে আজকে আছেন ডাঃ দেবনাথ ঘোষাল। ডাঃ ঘোষাল ইউনিভার্সিটি অফ মেলবোর্নের একজন গবেষক। বিজ্ঞানের যারা পাঠক, তারা হয়তো অনেকেই দেবনাথ ঘোষালের লেখা জীবাণুদের যত কথা ধারাবাহিকটা পড়েছেন। দীর্ঘ সময় ধরে দেবনাথ আমাদের সাথে আছেন এবং বহু আলোচনায় আমরা ওনাকে সাথে পেয়েছি। আজ আমরা সামনাসামনি তার থেকে জানতে চাইবো, তাঁর পথ চলার কথা, গবেষণার কথা।
দেবনাথ, তুমি একটু শ্রোতাদের বলো, কীভাবে পড়াশোনা শুরু করলে? কীভাবে গবেষণার জগতে এসে পৌঁছলে? আর গবেষক হিসেবে এখন কী ধরনের কাজ করছো?
দেবনাথ: আমার বাড়ি হচ্ছে বোলপুর, শান্তিনিকেতনে। ছোটবেলা থেকেই একটা ইচ্ছা ছিল গবেষণার কাজে যাওয়ার। কথাটা শুনতে হয়তো একটু অদ্ভুত লাগতে পারে। মনে হতে পারে, আমি ছোটবেলা থেকে গবেষণার কথা জানলাম কী করে?
গবেষণা বলতে প্রথাগত গবেষণার কথা হয়তো আমি ভাবতাম না। আমার শুধু এই ধরনের জিনিস মনে হতো: ধরো, শরীর খারাপ হয়েছে, ওষুধ খেলাম, তারপর ভালো হয়ে গেলাম। এটা কীভাবে হলো? অথবা ধরো, কেউ আমাকে কিছু বললো এবং আমি সেটার একটা উত্তর দিলাম। সে যে কথাটা বললো, সেটা আমি সঠিকভাবে বুঝতে পারলাম কী করে? এই সমস্ত ব্যাপারে আমি খুবই আগ্রহী ছিলাম। স্কুলে পড়ার সময় থেকেই আমার মনে হতো, এগুলো যদি আরো ভালো করে বুঝতে পারি তাহলে আরো ভালো লাগবে। নিজের অজান্তেই বিজ্ঞানে একটা আগ্রহ চলে এসেছিল।
কলেজে ঢোকার সময় সবাইকেই যে প্রশ্নটার সম্মুখীন হতে হয়, আমাকেও হলো: ডাক্তারি নিয়ে পড়বো, না ইঞ্জিনিয়ারিং নিয়ে, নাকি বিজ্ঞানের রাস্তায় যাবো। সেই যে বিজ্ঞান নিয়ে ভাবার ইচ্ছে ছিল, সেটা থেকেই আমি বায়োকেমিস্ট্রি নিয়ে অস্নাতকস্তরে (undergraduate) পড়ার কথা ভাবি। পশ্চিমবঙ্গে তখন এ বিষয়টা নিয়ে অস্নাতকস্তরে পড়ানো হতো না। তাই আমি রসায়ন নিয়ে পড়াশুনা করি। তারপরে মাস্টার্স ডিগ্রি করেছি বিশ্বভারতী থেকে, এবং পরবর্তীকালে টাটা ইনস্টিটিউট অফ ফান্ডামেন্টাল রিসার্চ (TIFR), মুম্বাই থেকে। TIFR-এ আমি রসায়ন থেকে জীববিদ্যায় শাখা পরিবর্তন করেছিলাম। যেহেতু একটা অন্য বিষয়ে চলে গেলাম, পরিবর্তনের সময়টা একটু কঠিন ছিল। কিন্তু সেসময় আমি সবারই সহযোগিতা পেয়েছি।
এরপর আমি পিএইচডি করি কেমব্রিজ বিশ্ববিদ্যালয় থেকে। এটা একটা মজার অভিজ্ঞতা ছিল। এখান থেকে এতজন নোবেল পেয়েছে বলে এটাকে অনেকসময় ব্রিটেনের নোবেল ফ্যাক্টরি বলা হয় [1]। ওখানে মেডিকেল কাউন্সিল অফ রিসার্চ (MRC) ল্যাবরেটরি অফ মলিকিউলার বায়োলজি নামে একটা সংস্থা আছে। সেখানে প্রচুর মৌলিক আবিষ্কার হয়েছে। প্রোটিন-এর কেলাসীয় গঠন (crystal structure) এখানেই প্রথম আবিষ্কার হয়। ক্রায়োইলেকট্রন মাইক্রোস্কোপের গবেষণাও এখানেই প্রথম শুরু হয়। অ্যান্টিবডি জিনিসটা এখানে আবিষ্কার হয়। মোট কথা, খুবই মজাদার একটা জায়গা ছিল।

এরপরে আমি ক্যালিফোর্নিয়া ইনস্টিউট অফ টেকনোলজি (CalTech) থেকে পোস্ট-ডক্টরেট গবেষণা করি। তারপরে ইউনিভার্সিটি অফ মেলবোর্নে আমি এখন সিনিয়র লেকচারার। এখানে আমার নিজস্ব ল্যাব আছে। এছাড়াও আমি কিছুটা পড়াই এখানে, কিন্তু আমরা মূল কাজটা গবেষণা করা।
আমার ল্যাবে গবেষণার মূল বিষয় ইলেকট্রন মাইক্রোস্কোপি। ব্যাকটেরিয়া, ভাইরাস, প্রোটিন, রাইবোজোম, ইত্যাদি ক্ষুদ্রাতিক্ষুদ্র জিনিসকে ইলেকট্রন মাইক্রোস্কোপের সাহায্যে দেখা যায়। যন্ত্রটা এতটাই শক্তিশালী যে এক একটা পরমাণুকে আলাদা করে দেখা যায় এতে। এই ধরনের যন্ত্রের মাধ্যমে আমরা বোঝার চেষ্টা করি, ক্ষতিকর ব্যাকটেরিয়া বা ভাইরাস জাতীয় জীবাণু কীভাবে মানুষ বা অন্যান্য স্তন্যপায়ীর কোষে আক্রমণ করে, এবং কীভাবে তার থেকে রোগ সৃষ্টি হয়। এইটা আমরা একেবারে ন্যানোমিটার স্তরে, অর্থাৎ খুব সূক্ষ্ম স্তরে গিয়ে বোঝার চেষ্টা করি।
বাহ। ছোটবেলায় বোলপুরে বসে কিছু জিনিস কীভাবে কাজ করে সেইটা জানার ইচ্ছে থেকে শুরু করে আজ অস্ট্রেলিয়াতে ইলেকট্রন মাইক্রোস্কোপের সাহায্যে একই ধরনের প্রশ্ন তুমি জানার চেষ্টা করছো। ব্যাপারটা ভাবলে খুব থ্রিলিং লাগে। তোমার ওয়েব পেজ দেখতে গিয়ে আমি ক্রায়োটোমোগ্রাফি (cryotomography) বলে একটা শব্দ সম্পর্কে জানলাম। আমি ইলেকট্রন মাইক্রোস্কোপি সম্পর্কে তো কিছুটা জানি, কিন্তু এই ক্রায়োটোমোগ্রাফি জিনিসটি কী?
ইলেকট্রন মাইক্রোস্কোপ আবিষ্কার হয় 1930-এর দশকে। আজ থেকে প্রায় একশো বছর আগে। আবিষ্কারের সাথে সাথেই বিজ্ঞানীরা বুঝতে পারলেন, এই নতুন মাইক্রোস্কোপের সাহায্যে আমরা অনেক নতুন ছোট ছোট জিনিস দেখতে পারবো। এর কারণ হলো, ইলেকট্রনের তরঙ্গদৈর্ঘ্য আলোর চেয়ে অনেক কম। তাই অণু-পরমাণু-ভাইরাস, ইত্যাদি অনেক ছোট ছোট জিনিস এতে ধরা পড়ে। এগুলো প্রথাগত মাইক্রোস্কোপের সাহায্যে দেখতে পাওয়া সম্ভব নয়, কারণ সেই দেখাটা আলোর তরঙ্গদৈর্ঘ্যের কারণে সীমিত।
“বিজ্ঞানীরা বুঝতে পারলেন, ইলেকট্রন মাইক্রোস্কোপ-এর সাহায্যে আমরা আরো অনেক ছোট জিনিস দেখতে পারবো, কারণ ইলেকট্রনের তরঙ্গদৈর্ঘ্য আলোর চেয়ে অনেক কম।”
মোটামুটি কত ছোট জিনিস আমরা দেখতে পাই?
প্রায় অ্যাংস্ট্রম স্কেলে। 10-10m প্রায়। ফলে, খুবই সূক্ষ্মাতিসূক্ষ্ম জিনিসগুলো দেখতে পাওয়া শুরু হলো।
আমরা জানি, আমাদের দেহ কোষ দিয়ে তৈরি। সবাই ভাবলো, হয়তো ইলেকট্রন মাইক্রোস্কোপের সাহায্যে এই কোষগুলোকে আরো ভালো করে দেখতে পাবো। 1950 -এর দিকে কোষের গঠন দেখার হিড়িক পড়ে গেল।
কিন্তু তখন এই গঠনগুলি লেখার জন্য যে পদ্ধতি ব্যবহার করা হতো তাকে বলা হয় ট্র্যাডিশনাল ইলেকট্রন মাইক্রোস্কোপি। এতে সমস্যা হলো, কোষ পর্যবেক্ষণের সময় যথেষ্ট কন্ট্রাষ্ট (contrast) আসে না। অর্থাৎ আলাদা করে বোঝা যায় না, কোথায় মাইটোকন্ড্রিয়া, কোথায় নিউক্লিয়াস, বা কোথায় এন্ডোপ্লাজমিক রেটিকুলাম (ER) ইত্যাদি রয়েছে।
এরপরে আসে নেগেটিভ স্টেনিং ইলেক্ট্রন মাইক্রোস্কোপি। তাতে কোষের বিভিন্ন ধরনের গঠন যেরকম — ই. আর. (ER) রাইবোজোম ইত্যাদিগুলিকে স্টেনিং করে (stain) ইলেকট্রন মাইক্রোস্কোপের মাধ্যমে দেখা এবং ছবি তোলা হতো। ষাট, সত্তর, আশির দশক অব্দি এই পদ্ধতিটা চালু ছিল। কোষের গঠন এবং ভিতরকার সজ্জা, যা আমরা জীবন বিজ্ঞানের বইয়ে পড়েছি — যেমন ই আর, গলগি বডি, বিভিন্ন অঙ্গাণু (organelle) — এগুলো আমরা মাইক্রোস্কোপের মাধ্যমেই জানতে পেরেছি।
কিন্তু নব্বইয়ের দশকে এসে বিজ্ঞানীরা একটা সমস্যা দেখতে পেলেন। নেগেটিভ স্টেনিং পদ্ধতিটিতে নমুনাগুলিকে ভারী ধাতু (heavy metal) দিয়ে আবরিত করা হতো। এতে নমুনাগুলির বাস্তবে যে আকার রয়েছে, সেটা থেকে পরিবর্তিত হয়ে যেত।
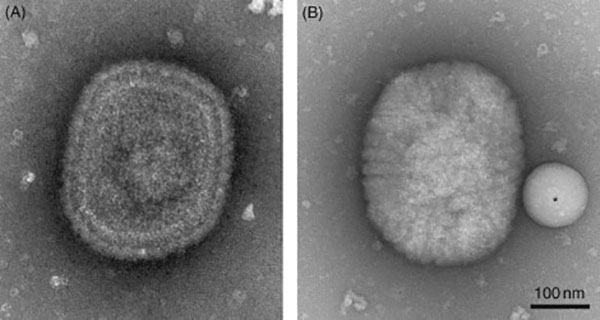
তাই স্টেনিং পদ্ধতির বিকল্প খোঁজা শুরু হলো, যাতে কোষের আকার অপরিবর্তিত রেখে আমরা পর্যবেক্ষণ করতে পারি। বিজ্ঞানীরা ভাবতে শুরু করলেন, ওই স্টেনিং-টা না করেও কি কোষের ভিতরে আলাদা করে অঙ্গাণুগুলো দেখা সম্ভব?
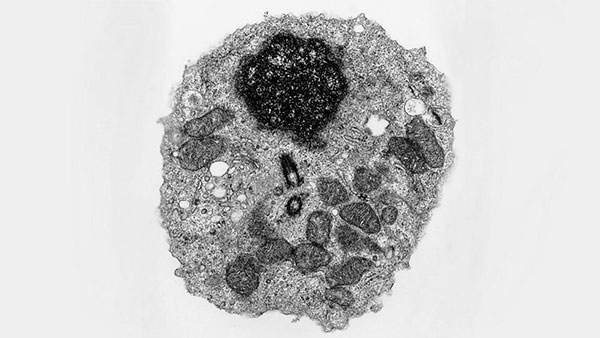
সমাধান হিসেবে বিজ্ঞানীরা ভাবলেন, কোষটাকে যদি প্রচণ্ড দ্রুত ঠান্ডা করে ফেলা যায়, কেমন হয়? তরল নাইট্রোজেন বা হিলিয়ামে ফেলে এই ঠান্ডা করার কাজটা সেরে ফেলা যায়। কোষের ভেতরে জলের অণু রয়েছে। এমনিতে জলকে বরফ করলে সেটা একটা ত্রিমাত্রিক সজ্জা (three-dimensional structure) ধারণ করে। কিন্তু দ্রুত ঠান্ডা করলে সেই সজ্জাটা তৈরি হওয়ার সময়টাই পায় না। যে অণুগুলো যেখানে আছে, সেখানেই স্থির হয়ে যায়।
এ অবস্থায় জমে থাকা কোষটিকে ইলেকট্রন মাইক্রোস্কোপের নিচে দেখলে তার অপরিবর্তিত রূপ দেখা যায়। এতে কন্ট্রাস্ট খুব বেশি না হলেও বোঝা যায়, কোনটা নিউক্লিয়াস বা কোনটা ER। তিন থেকে চার ন্যানোমিটার রেজোলিউশনে দেখা যায় কোষের ভেতরে কোথায় কী রয়েছে।
যেহেতু এটা ক্রায়ো অর্থাৎ ঠান্ডা অবস্থায় দেখা হয়, তাই একে বলা হয় ক্রায়ো-ইলেকট্রন মাইক্রোস্কোপি (cryo-electron microscopy)।
“যেহেতু কোষটাকে ক্রায়ো অর্থাৎ ঠান্ডা অবস্থায় দেখা হয়, তাই একে বলা হয় ক্রায়ো-ইলেকট্রন মাইক্রোস্কোপি।”
এই ক্রায়ো-ইলেকট্রন মাইক্রোস্কোপি একটা বড়সড় পরিবর্তন নিয়ে এলো। প্রথাগত মাইক্রোস্কোপের যে পদ্ধতি তাতে রেজলিউশন (resolution) খুব বেশি আসতো না। কোনো মাইক্রোস্কোপ খুব কাছাকাছি দুটি বিন্দুকে কত ভালো ভাবে আলাদা করে দেখাতে পারে, সেটাকে বলে রেজলিউশন। যেখানে প্রথাগত মাইক্রোস্কোপি-তে হয়তো 50 ন্যানোমিটার রেজোলিউশনে দেখা যাচ্ছে কোনো একটি নমুনাকে, সেখানে ক্রায়ো ইলেকট্রন মাইক্রোস্কোপিতে অনেক বেশি রেজোলিউশনে একই নমুনাকে দেখা গেল। কারণ এতে কোনো হেভি মেটালের ব্যবহার ছিল না বা কীভাবে স্যাম্পল তৈরি হচ্ছে, তার উপর দেখাটা নির্ভর করতো না। এই পদ্ধতি আবিষ্কারের পর আমরা কোষের গঠন সম্পর্কে অনেক ভালোভাবে জানতে পারি। কিন্তু অবশ্যই 1980 সালে এই পদ্ধতি আবিষ্কারের সাথে সাথেই সেটা এতটা নিখুঁত হয়নি। এর পরেও প্রায় 30 বছর সময় লেগেছে ধীরে ধীরে উন্নতি হতে। গত পাঁচ-দশ বছরে এসে আমরা কোষের গঠন অনেক হাই রেজোলিউশনে — প্রায় 3-4 ন্যানোমিটার রেজোলিউশনে দেখতে পাচ্ছি। কোষের সম্বন্ধে আমাদের যে ধারণা, সেটা আরো অনেক স্পষ্ট হচ্ছে।
আচ্ছা আচ্ছা। এই ব্যাপারটা নিয়ে আমার কোনো ধারণা ছিল না। এখন মনে অনেক প্রশ্ন তৈরি হচ্ছে।
আচ্ছা, কোষের বাইরে তো একটা আবরণী পর্দা আছে। তাহলে কোষকে আমরা দ্রুত ঠান্ডা করে দেখার সময় মাইটোকনড্রিয়া, গলগি বডি, ইত্যাদি বস্তুগুলি কোষ পর্দা না কেটেই দেখতে পারি?
হ্যাঁ এটা খুবই সুন্দর একটা প্রশ্ন। এখানেই ক্রায়ো-ইলেকট্রন মাইক্রোস্কোপির সাথে ক্রায়ো-ইলেকট্রন টোমোগ্রাফির (cryo-electron tomography) পার্থক্য বোঝা যায়।
ক্রায়ো-ইলেকট্রন মাইক্রোস্কোপের ক্ষেত্রে পদ্ধতিটি হলো, আমরা নমুনাটাকে মাইক্রোস্কোপের নিচে রাখলাম এবং এর মধ্যে দিয়ে ইলেকট্রন চলাচল করালাম, তারপর সেটার ছবি তোলা হলো। সেইভাবে দেখার চেষ্টা হয়, কোষের ভেতরে কী জিনিসপত্র আছে।
কিন্তু কোষ তো একটা ত্রিমাত্রিক বস্তু। যখন ওই ইলেকট্রনগুলো নমুনার মধ্যে যাত্রা করে, তারা বিভিন্ন অঙ্গাণুর সাথে আন্তঃক্রিয়া (interact) করতে পারে। সবরকম আন্তঃক্রিয়া-র পর ইলেক্ট্রন ক্যামেরায় এসে পৌঁছয়। সেখানে কিন্তু আর ত্রিমাত্রিক পথের পুরো ছবিটা পাওয়া যায় না। সেটা তখন দ্বিমাত্রিক ছবিতে পরিবর্তিত হয়ে গেছে। (তুলনা হিসেবে বলা যায়, একটা মোমবাতির সামনে কোনো বস্তুকে রাখা হলো। দেওয়ালে সেই বস্তুটার একটা ছায়া পড়লো। ছায়াটা কিন্তু ত্রিমাত্রিক বস্তুর দ্বিমাত্রিক একটা প্রতিচ্ছবি মাত্র। সেটা থেকে পুরো মোমবাতিটাকে বোঝা একটু মুশকিল।)
এর সমাধান স্বরূপ আমরা ক্রায়োটোমোগ্রাফি করি। এটা একটা ত্রিমাত্রিক ছবি তোলার পদ্ধতি। ধরো তুমি আমার ছবি তুলছো। সামনে থেকে যদি একটা ছবি তোলো তাহলে তুমি বুঝতে পারবে আমি কী রকম দেখতে। কিন্তু এইটা বুঝতে পারবে না যে আমার আকার-আয়তন কী রকম। এবার ধরো, তুমি বিভিন্ন দিক থেকে অনেকগুলো ছবি তুললে। সেই ছবিগুলোকে ব্যবহার করে যদি আমার ত্রিমাত্রিক চেহারাটা পুনর্গঠন করার চেষ্টা করো, তখন বুঝতে পারবে আমার আয়তন কী রকম।
ক্রায়ো-ইলেক্ট্রন টোমোগ্রাফিও খানিকটা সেরকম। একটা ত্রিমাত্রিক বস্তুর শুধু একটা দিক থেকে ছবি না তুলে আমরা মাইক্রোস্কোপ-টাকে ঘুরিয়ে ঘুরিয়ে বিভিন্ন কোণ থেকে ছবি তুলি। সেই ছবিগুলো নিয়ে বস্তুটার ত্রিমাত্রিক চেহারাটা পুনর্গঠন করার চেষ্টা করা হয়। এখানে পদার্থবিদ্যার কিছুটা ব্যাপার রয়েছে। আমরা ত্রিমাত্রিক ফুরিয়ার স্থানে (three-dimensional Fourier space) এই পুনর্গঠনের কাজটা করছি।
এই পদ্ধতিতে আমরা বুঝতে পারি কোষের মধ্যে অঙ্গাণুগুলি, যেমন নিউক্লিয়াস, রাইবোজোম, গলগি বডি, ইত্যাদি কোথায় কোথায় কীভাবে আছে। এখনো পর্যন্ত এটাই একমাত্র পদ্ধতি যার মাধ্যমে কোনো জৈব বস্তুর পুরো ত্রিমাত্রিক ছবিটা সবথেকে বেশি রেজোলিউশনে তুলতে পারি। আলোর মাইক্রোস্কোপি-তেও একটা পদ্ধতি রয়েছে যাকে বলে কনফোকাল মাইক্রোস্কোপি (confocal microscopy), তাতেও ত্রিমাত্রিক ছবি পাওয়া যায়। কিন্তু রেজোলিউশনের দিক থেকে দেখলে এই ক্রায়ো-ইলেক্ট্রন টোমোগ্রাফিই ত্রিমাত্রিক ছবি তোলার সবথেকে শ্রেষ্ঠ উপায়।
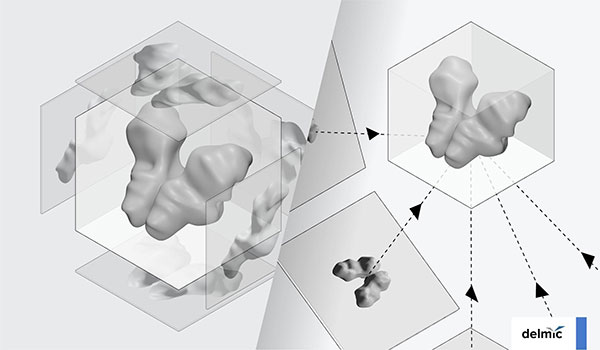
আচ্ছা এইবার বুঝতে পারলাম ক্রায়োটোমোগ্রাফি ব্যাপারটা। তোমরা কি ওই ছবিটা খালি চোখে দেখতে পাও নাকি ছবিটা শেষমেশ কম্পিউটার স্ক্রিনে দেখো কিছুটা প্রসেস করার পর?
যেটা করা হয়, সেটা হলো কোষটাকে মাইক্রোস্কোপের তলায় রাখা হয়। তারপর আস্তে আস্তে করে সেটাকে বিভিন্ন কোণে ঘোরাতে থাকি। এতে প্রতি মুহূর্তে নমুনাটার বিভিন্ন দিক থেকে দ্বিমাত্রিক ছবি উঠতে থাকে। এই ছবিগুলো আমরা খালি চোখে দেখতে পাই।
ইলেকট্রন মাইক্রোস্কোপিতে এটাই মজা। ধরো তুমি কোনো একটা প্রোটিনের গঠনসজ্জা বুঝতে চাও, তার জন্য তুমি এন-এম-আর (NMR বা Nuclear Magnetic Resonance) করতে পারো। এতে তুমি হয়তো গ্রাফে কিছু কিছু চূড়া দেখতে পাবে। কিন্তু ইলেকট্রন মাইক্রোস্কোপিতে তুমি সেই প্রোটিন যৌগটাকেই সরাসরি দেখতে পাবে। সেটা খুবই ছোট, এমনিতে দেখা যেত না, কিন্তু সেটাকে একদম চাক্ষুষ আমরা দেখতে পাচ্ছি। এটা খুবই বড় একটা ক্ষমতা বলে আমার মনে হয়।
যেমন ধরো, গত কয়েক বছরে আমরা কোভিড ভাইরাস (SARS-CoV-2) নিয়ে অনেক ভুগেছি। এই SARS-CoV-2 ভাইরাসটিকে যদি ইলেকট্রন মাইক্রোস্কোপের নিচে রাখা হয়, তুমি কিন্তু সেটার অপরিবর্তিত রূপটা দেখতে পাচ্ছো। ভাইরাসের উপর যে স্পাইক প্রোটিনগুলো থাকে, সেগুলোকে একদম সরাসরি দেখতে পাচ্ছো। এই স্পাইক প্রোটিনগুলোর মাধ্যমেই কিন্তু ভাইরাসটি আমাদের কোষের গ্রাহক অণুগুলির (cell receptor) সাথে বিক্রিয়া করে কোষের ভেতরে প্রবেশ করে। একইভাবে বিভিন্ন ব্যাকটেরিয়ার কিছু নিঃসরণ পদ্ধতি (secretion system) রয়েছে যার মাধ্যমে সেগুলো আমাদের কোষে বিষাক্ত পদার্থ ঢুকিয়ে দিতে পারে।
এই জিনিসগুলো যদি আমরা সরাসরি দেখতে পাই এবং এদের গঠনটা বুঝতে পারি, তাহলে আমরা সেইমতো ওষুধ ডিজাইন করতে পারবো। ধরো, ওই স্পাইক প্রোটিন-এর অমুক জায়গায় আমরা একটা বাঁধা (binding) তৈরি করে দিলাম যাতে সেটা আর কোষের সাথে ক্রিয়া করতে না পারে।
তাই, নতুন ওষুধ আবিষ্কারের (drug discovery) ক্ষেত্রে ক্রায়ো-ইলেক্ট্রন মাইক্রোস্কোপি একটা বড়সড় ভূমিকা নিচ্ছে। শত্রু জীবাণুগুলো কীভাবে বিষাক্ত পদার্থ ছড়িয়ে দেয়, সেটা আণবিক স্তরে বুঝতে পারার ফলে সেগুলোকে আটকে দেওয়ার নিত্যনতুন পদ্ধতি তৈরি হচ্ছে।
(লেখাটি মুল ইন্টারভিউ-এর ভিত্তিতে লিপিবদ্ধ করেছেন স্বপ্ননীল জানা।)
প্রচ্ছদের ছবি: pexels (Edward Jenner)
উৎসাহী পাঠকদের জন্য :
[১] কেমব্রিজ বিশ্ববিদ্যালয়ের নোবেলজয়ী তৈরির ইতিহাস জানতে ক্যাভেন্ডিস ল্যাবরেটরিতে ইতিহাস পরিক্রমা লেখাটি পড়তে পারেন।
লেখাটি অনলাইন পড়তে হলে নিচের কোডটি স্ক্যান করো।
Scan the above code to read the post online.
Link: https://bigyan.org.in/how-to-see-microbes
