রক্তনালিতে জমাট বেঁধে যাওয়ার ফলে মস্তিষ্কে রক্তের সাপ্লাই কমে গেলে যে স্ট্রোক হয়, সেটাকে ইসকেমিক স্ট্রোক (ischemic stroke) বলে। এটা বয়সকালের আকস্মিক দুর্ঘটনার জগতে খুব পরিচিত একটা ঘটনা। এতে স্নায়ুর সমূহ ক্ষতি এবং মৃত্যুও হতে পারে। বেঁচে গেলেও স্নায়ুর ক্ষতির ফলে স্বাভাবিক অবস্থায় ফিরে আসা খুব কঠিন হয়ে যেতে পারে।
এখন প্রশ্ন হচ্ছে — এই ঘটনার ঝুঁকি কতটা, সেটা কি আগে থেকে নির্ণয় করা যায়? এটা যে হতে চলেছে, সেটা কোনোভাবে আগে থেকে বোঝা যায়? কিম্বা এই ঘটনার চিকিৎসা হিসেবে কি স্নায়ুগুলোকে পুনর্গঠন করা যায়?
এই প্রশ্নের উত্তর শুধু একজন মানুষের জিন সিকোয়েন্সিং (gene sequencing) করে বলা কঠিন। কারণ এরকম একটা ঘটনার পিছনে শুধু জিনগত কারণই দায়ী নয়। আবার শুধু স্ট্রোক-আক্রান্ত রোগীর কোষের প্রোটিনগুলোকে তদারক করলে শুধু তাৎক্ষণিক অবস্থাটাই বোঝা যাবে, তাই শুধু তাৎক্ষণিক প্রোটিনের উপর নজর রাখলেই চলবে না।
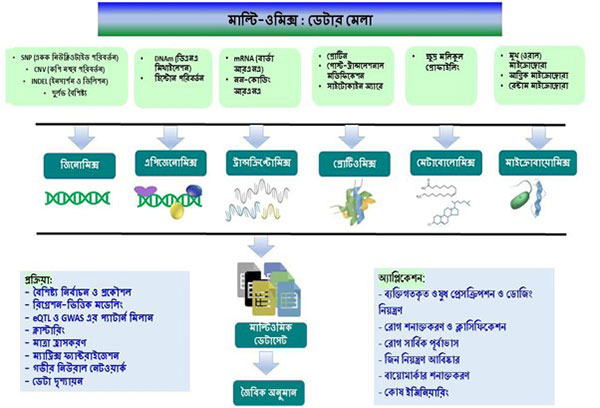
তাই অনেক ধরনের তথ্যনির্ভর গবেষণা পদ্ধতির সমন্বয়ে তৈরি হয়েছে মাল্টি-ওমিক্স (multi-omics) প্রযুক্তি। বিভিন্ন ধরনের প্রযুক্তি থেকে যে তথ্য (data) পাওয়া যায়, সেগুলোকে একজোট করে কোনো একটা জটিল জীববৈজ্ঞানিক প্রশ্নের উত্তর খোঁজারই একটা গালভরা নাম এই মাল্টি-ওমিক্স।
এবার দেখা যাক, এই মাল্টি-ওমিক্স প্রযুক্তির আওতায় কী কী পড়ে।
তথ্য সংগ্রহ (data collection)
মাল্টি-ওমিক্স হলো বিভিন্ন ধরনের জৈবতথ্য সংগ্রহ প্রযুক্তির সমন্বয়। একেকটা প্রযুক্তিকে আলাদা করে দেখা যাক।
জন্মসূত্রে পাওয়া স্ট্রোকের ঝুঁকি — জেনোমিক্স (genomics)
একভাবে ভাবলে জেনোমিক্স প্রযুক্তি এই মাল্টি-ওমিক্স প্রযুক্তির গোড়ায় রয়েছে। কারণ একেবারে জন্মসূত্রে পাওয়া বৈশিষ্ট্যগুলো একজন মানুষের জিনোম (genome) পড়ে তবেই বোঝা যায়।
জিনোম-কে ভাবতে পারো A, T, G, C এই অক্ষরগুলোর একটা বিশেষ ক্রমবিন্যাস (sequence)। এই অক্ষরগুলো আসলে চার ধরনের রাসায়নিক যৌগকে চিহ্নিত করে। একজন মানুষের জিনোমের মধ্যে কোন বিন্যাসে সাজানো আছে এই অক্ষরগুলো (বা যৌগগুলো), সেটাই বলে দেয় তার জন্মসূত্রে পাওয়া বৈশিষ্ট্যগুলো।
অনেক রোগের ক্ষেত্রে রোগের ঝুঁকি কতটা, তার কিছুটা জন্মসূত্রেই নির্ধারিত হয়ে থাকে। সেটা বুঝতে জিনোম-এর ওই অক্ষরের বিন্যাসটাকে পড়তে হয় এবং কিছু রেফারেন্স বিন্যাসের সাথে তুলনা করতে হয়। এই পড়ার প্রযুক্তিটাকে বলে জিন সিকোয়েন্সিং (gene sequencing)।
জিন সিকোয়েন্সিং করে কী ধরনের জিনিস বোঝা যায়, নীচের ছবিতে তার একটা উদাহরণ দেওয়া হলো। এটাকে বলে SNP বা সিঙ্গেল নিউক্লিওটাইড পলিমরফিজম (single-nucleotide polymorphism)। এখানে কোনো একটা রেফারেন্স বিন্যাসের সাথে ঠিক একটা অক্ষরের তফাত রয়েছে।
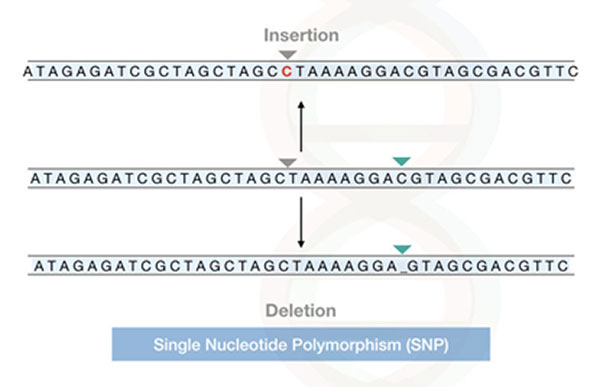
এরকম আরো নানা ধরনের জিনগত পরিবর্তন (genetic mutation) জিন সিকোয়েন্সিং করে বার করা যায়। এবং এর মধ্যে এক বা একাধিক পরিবর্তনের সাথে রোগের ঝুঁকির কোনো সম্পর্ক আছে কিনা, গবেষণার মাধ্যমে সেটা সাব্যস্ত করা যায় [1]।
এরকমই বেশ কিছু জিনগত চিহ্ন নির্ধারণ করা গেছে যেগুলোতে স্ট্রোক জাতীয় ঘটনার ঝুঁকি বেড়ে যায়। যেমন, কিছু জিন রয়েছে যারা দেহের কোলেস্টেরল সামলানোর জন্য দায়ী প্রোটিনগুলো তৈরি করে। সেই জিনের কিছু পরিবর্তনের সাথে স্ট্রোক-এর ঝুঁকি বেড়ে যাওয়ার সম্ভাবনা দেখা গেছে। সেই পরিবর্তনগুলো কারো জিন সিকোয়েন্সিং করে পাওয়া গেলে বলা যেতে পারে তার স্ট্রোক হওয়ার সম্ভাবনা স্বাভাবিক-এর থেকে বেশি।
পরিবেশের কারণে স্ট্রোকের ঝুঁকি — এপিজেনোমিক্স (epigenomics)
কিন্তু জন্মসূত্রে পাওয়া জিন-ই শেষ কথা নয়। কারণ ওই অক্ষরের সারির গোটাটা কার্যকরী হয় না। একজন মানুষের কোন জিন-টা কার্যকরী হবে আর কোনটা হবে না, তার গোটা জীবন ধরে সেই নিয়ে টানা হ্যাঁচড়া চলতে থাকে। খাদ্যাভ্যাস, স্ট্রেস, বিষাক্ত কিছুর প্রভাব, সবেতেই কিছু জিন চুপ করে যেতে পারে (gene silencing)।
জিন চুপ করে যাওয়া মানে কী? এমনিতে ওই অক্ষরের সারিতে লেখা থাকে কোন প্রোটিন তৈরি হবে কোষের মধ্যে — তিনটে করে অক্ষর একটা করে প্রোটিন-এর একক বানায় [2]। সেই প্রোটিন-ই কোষের যাবতীয় কাজ করে। এই অক্ষরের সারি থেকে কাজের জিনিস তৈরি হওয়াটাকে জিন-এর অভিব্যক্তি (gene expression) বলে। কিন্তু কিছু প্রক্রিয়া রয়েছে যাতে এই অভিব্যক্তিটাকে চাপা দেওয়া যায়। যেমন কোনো একটা অক্ষরের রাসায়নিক-এর ঘাড়ে একটা মিথাইল গ্রুপ জুড়ে দিলে প্রোটিন তৈরির পদ্ধতিটা শুরুই হতে পারে না — এটাকে বলে ডিএনএ মিথাইলেশন (DNA methylation)।
এরকম আরো রাসায়নিক প্রক্রিয়া রয়েছে যেগুলো জিন-এর অভিব্যক্তির পরিবর্তন করতে পারে।
এই ধরনের রাসায়নিক প্রক্রিয়ার চিহ্ন খোঁজাকেই বলে এপিজেনোমিক্স (epigenomics)। বেশ কিছু এরকম চিহ্ন (epigenetic markers) পাওয়া গেছে যার সাথে স্ট্রোক জাতীয় ঘটনার ঝুঁকি বেড়ে যাওয়ার সম্ভাবনা দেখা যায়।
স্ট্রোক-পরবর্তী অবস্থার ছবি — ট্রান্সক্রিপ্টোমিক্স (transcriptomics)
জন্মসূত্রে পাওয়া জিনগোষ্ঠী (উপরের অক্ষরের সারি), তার অভিব্যক্তি পাল্টায় সারা জীবন ধরে। তাই কোনো এক বিশেষ সময়ে সেই স্থির অক্ষরের সারি থেকে কী পাওয়া যাবে, সেটাও নির্ধারণ করার প্রয়োজন আছে।
জিন-এর অভিব্যক্তিতে প্রভাব ফেলতে পারে, এমন প্রক্রিয়ার চিহ্ন খোঁজা হয় এপিজেনোমিক্স পদ্ধতিতে। কিন্তু কোনো এক মুহূর্তে জিন-এর অভিব্যক্তি কীরকম, সেইটা বোঝার পদ্ধতিকে ট্রান্সক্রিপ্টোমিক্স (transcriptomics) বলা হয়।
এই পদ্ধতিতে আসলে আরএনএ-কে সিকোয়েন্সিং (RNA sequencing) করা হয়। জিন থেকে প্রোটিন, এই পথে যাওয়ার একটা মধ্যবর্তী ধাপে আরএনএ তৈরি হয় — সেটাও একটা অক্ষরের সারি [2]।
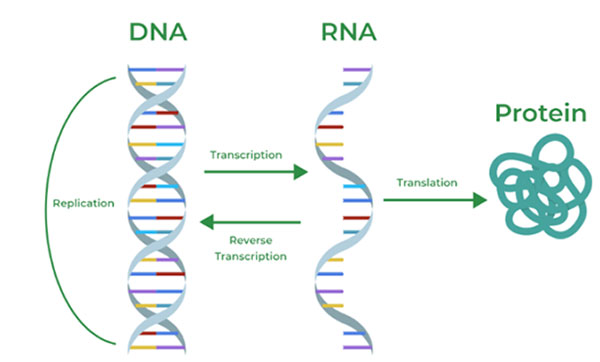
কিন্তু কোথাও জিন চুপ করে থাকলে সেই জায়গাটা থেকে আরএনএ তৈরি হয় না। তাই কোনো এক মুহূর্তে কোন আরএনএ কতটা তৈরি হয়েছে, সেইটা যদি মেপে ফেলা যায়, তাহলে সেই মুহূর্তে জিন-এর অভিব্যক্তির একটা ছবি পাওয়া সম্ভব।
স্ট্রোক হওয়ার ঠিক পরবর্তী মুহূর্তে এই কাজটা করলে মস্তিষ্কে কী পরিবর্তন ঘটেছে, তার একটা ছবি পাওয়া যায়। কোন জিনগুলো সক্রিয় রয়েছে এবং কাদের সাহায্য নেওয়া যায় মস্তিষ্কের পুনর্গঠন ও মেরামতিতে, সেগুলোকে চিহ্নিত করা যায়। ফলে স্ট্রোক থেকে আরোগ্যলাভের চিকিৎসা পথটাকে একদম সেই রোগীর কথা মাথায় রেখে তৈরি করা যায় (personalized drug development)।
স্ট্রোকের পেছনে প্রোটিনের ভূমিকা — প্রোটিওমিক্স (proteomics)
আগেই বলা হলো, একটা জীবকোষের যাবতীয় কাজ করে প্রোটিন। তাই, একটা বা একাধিক কোষে কী কী প্রোটিন কতটা রয়েছে, সেইটা মাপলে সেই কোষের কাজকর্মের একটা স্পষ্ট ছবি পাওয়া যায়। সেই প্রোটিন মাপার পদ্ধতিগুলোকে সম্মিলিতভাবে প্রোটিওমিক্স (proteomics) বলা হয়। একটা স্যাম্পলের মধ্যে প্রোটিন খুঁজতে মাস স্পেক্ট্রোমেট্রি (mass spectrometry) কিম্বা মাল্টিডাইমেনশনাল প্রোটিন সিকোয়েন্সিং (multidimensional protein sequencing), এই পদ্ধতিগুলো ব্যবহার করা হয়।
ইস্কেমিক স্ট্রোক যে হয়েছে, সেইটা রক্তের স্যাম্পলে কিছু প্রোটিন-এর পরিবর্তন থেকে বোঝা যায়। সেই প্রোটিনগুলোকে স্ট্রোকের “জীবচিহ্ণক” অথবা বায়োমার্কার (biomarker) হিসাবে ব্যবহার করা হয়। সাধারণ মানুষের তুলনায় স্ট্রোক-আক্রান্ত রোগীর কোষে সেই প্রোটিনগুলো বেশি বা কম মাত্রায় দেখা যায়।
আবার চিকিৎসায় কোন প্রোটিনগুলো কাজে লাগবে, সেটাও গবেষণা থেকে বার করা যায়। গবেষণাতে দেখা হয়, একটা স্ট্রোক হলে আসলে কোষীয় স্তরে কী ঘটছে এবং সেই ঘটনার জন্য কোন প্রোটিনগুলো দায়ী। স্ট্রোক-এর প্রভাব শুধু স্ট্রোক হওয়ার কিছুক্ষণ নয়, তার অনেকদিন পর অব্দি চলতে পারে। যদি এমন ওষুধ বানানো যায় যেটা কোনো একটা প্রোটিনের পথে বাধা দেবে (অন্য কোনো স্বাভাবিক কাজ ব্যাহত না করে), তাহলে স্ট্রোক-এর মারাত্মক প্রভাবকে প্রশমিত করা যায়।
স্ট্রোক-পরবর্তী অবস্থায় জীবনধারণের প্রক্রিয়াগুলো কেমন চলছে — মেটাবোলোমিক্স (metabolomics)
জীবন চালু রাখতে জীবকোষের মধ্যে নানারকম বিক্রিয়া প্রতিনিয়ত হয়ে চলেছে। এইগুলোকে একসাথে বলে মেটাবলিসম (metabolism)। যেমন, কোষের মধ্যে খাদ্য থেকে আহরিত গ্লুকোজ ভেঙে কোষের শক্তির উৎস ATP তৈরি হয়। এই ধরনের বিক্রিয়ার ফলে যেসব অপেক্ষাকৃত ছোট রাসায়নিক তৈরি হয় (প্রোটিন-এর থেকে ছোট), সেগুলোকে বলে মেটাবোলাইট (metabolites)।
রক্ত বা মূত্রের স্যাম্পলে নানারকম মেটাবোলাইট-কে আলাদা করার পদ্ধতিগুলোকে সম্মিলিতভাবে বলে মেটাবোলোমিক্স (metabolomics)। গ্যাস ক্রোমাটোগ্রাফি-মাস স্পেকট্রোমেট্রি (GC-MS) এবং লিকুইড ক্রোমাটোগ্রাফি-মাস স্পেকট্রোমেট্রি (LC-MS), এই পদ্ধতিগুলোর সাহায্যে একটা স্যাম্পল থেকে বিভিন্ন মেটাবোলাইট-গুলোকে আলাদা করা হয়।
স্ট্রোক-আক্রান্ত রোগীর মেটাবোলাইট-এর তারতম্য থেকেও বোঝা যায় কোষের কোন স্বাভাবিক প্রক্রিয়াগুলো ব্যাহত হয়েছে — যেমন, কোথায় শক্তি কমে গেছে বা কোথায় কোষের মধ্যে সিগনালের পথগুলো পাল্টে গেছে। অর্থাৎ, প্রোটিন-এর মতো বিভিন্ন মেটাবোলাইট-ও স্ট্রোক-এর বায়োমার্কার-এর (biomarker) কাজ করে। একইরকমভাবে, চিকিৎসার ক্ষেত্রেও একজন রোগীর মেটাবোলাইট-এর চিত্র থেকে নির্ণয় করা যায়, কী ধরনের চিকিৎসা তার জন্য কাজে দেবে।
স্ট্রোকের পিছনে দেহের ব্যাকটেরিয়ার ভূমিকা — মাইক্রোবায়োমিক্স (Microbiomics)
আমাদের দেহের বিভিন্ন শারীরবৃত্তীয় প্রক্রিয়াতে শুধু আমাদের কোষগুলো নয়, আমাদের দেহে অবস্থিত লক্ষ কোটি ব্যাক্টেরিয়ারও একটা ভূমিকা রয়েছে। তারা খাবার হজম করা থেকে শুরু করে রোগ প্রতিরোধ, সবেতেই একটা ভূমিকা পালন করে [3]। এক অর্থে, আমাদের স্বাভাবিক জীবনটা কিছুটা এদের উপর দাঁড়িয়ে আছে।
দেহে বাসা করা ব্যাকটেরিয়া এবং অন্যান্য জীবাণুর বাস্তুতন্ত্রটাকে (ecosystem) এক কথায় মাইক্রোবায়োম (microbiome) বলে। এবং সেই বাস্তুতন্ত্রে নানারকম ব্যাকটেরিয়া কলোনির উপস্থিতি এবং ভূমিকা নির্ণয় করার পদ্ধতিগুলোকে সম্মিলিতভাবে মাইক্রোবায়োমিক্স (microbiomics) বলে।
আমাদের পাচনতন্ত্রে (digestive system) উপস্থিত মাইক্রোবায়োম-এর নানা তারতম্যের সাথে স্ট্রোকের ঝুঁকির সম্পর্ক পাওয়া গেছে। যেমন, ব্যাকটেরিয়াগুলো তাদের কাজ ঠিকমতো না করলে রক্তনালির দেওয়ালে পলি (plaques)পড়ে রক্ত চলাচল কমিয়ে দিতে পারে। তাই, মাইক্রোবায়োম-এ স্বাভাবিক ব্যাকটেরিয়া কলোনিগুলো আছে কিনা, সেটা থেকেও স্ট্রোকের ঝুঁকি নির্ণয় করা যায়। আবার, চিকিৎসার ক্ষেত্রেও এই মাইক্রোবায়োম-এর সাহায্য নেওয়া যায়।
তথ্য বিশ্লেষণ (data analysis) এবং ফলাফল যাচাই (biological validation)
প্রত্যেকটা ওমিক্স পদ্ধতিতেই অনেক তথ্য আসে এবং সেগুলোকে একত্রে বিশ্লেষণ করার একটা ব্যাপার থাকে। বিশ্লেষণ করার অনেক পদ্ধতি হতে পারে:
- স্ট্যাটিস্টিক্যাল পদ্ধতি (statistical methods): মাল্টি-ওমিক্স ডেটার বিশ্লেষণে বিভিন্ন স্ট্যাটিস্টিক্যাল মডেল (statistical model) ব্যবহার করা হয়। যেমন, পারশিয়াল লিস্ট স্কোয়ারস রিগ্রেশন (partial least squares regression)। যেখানে একটা ঘটনার পিছনে প্রচুর সম্ভাব্য কারণ থাকতে পারে এবং সেই কারণগুলোর নিজেদের মধ্যেও একটা কার্যকারণ সম্পর্ক (cause-effect relationship) থাকতে পারে, সেরকম অবস্থায় এই পদ্ধতিটা খুবই কাজের।
- জৈবরাসায়নিক পথ ভিত্তিক বিশ্লেষণ (pathway analysis): যেটা আগেই বলা হয়েছে — স্বাভাবিক অবস্থা থেকে কোনো একটা বিচ্যুতির পিছনে নানারকমের অণুর অবদান থাকতে পারে: জিন, প্রোটিন এবং অন্যান্য অণু। এইসব অণুগুলোকে একত্রে সেই ঘটনাটার জৈবরাসায়নিক পথ (biochemical pathway) বলে। পথ ভিত্তিক বিশ্লেষণে (pathway analysis) বিভিন্ন ওমিক্স স্তরের তথ্যকে একত্রিত করে সেই নির্দিষ্ট পথটাকে চিহ্নিত করা হয়, যা রোগের প্রক্রিয়া বুঝতে সাহায্য করে।
- মেশিন লার্নিং (machine learning) এবং নিউরাল নেটওয়ার্ক (neural network) ভিত্তিক পদ্ধতি: বিভিন্ন স্তরের ডেটাকে একত্র করার জন্য মেশিন লার্নিং (ML) অ্যালগোরিদম এবং কৃত্রিম নিউরাল নেটওয়ার্ক (artificial neural network) ব্যবহৃত হয়, যা নতুন সম্পর্ক এবং প্যাটার্ন আবিষ্কারে সহায়তা করে।
- প্যানোমিক বিশ্লেষণ (panomics analysis): বিভিন্ন ওমিক্স স্তরের তথ্যকে একত্রিত করে একটি সমন্বিত মডেল তৈরি করা হয়। এটি রোগের কারণ এবং সম্ভাব্য চিকিৎসার লক্ষ্যমাত্রা চিহ্নিত করতে সাহায্য করে।
এই ধরনের গবেষণায় সাধারণত এত তথ্য জড়ো হয় যে সেগুলোকে স্টোর করা এবং একত্রে বিশ্লেষণ করাটাই একটা পরিশ্রমসাপেক্ষ কাজ। অনেক ক্লাউড-বেসড টুলস (cloud based tools) বেরিয়েছে যেগুলো এই ডেটা স্টোর এবং বিশ্লেষণের কাজটা সহজ করে দিয়ে
গবেষকদের জন্য সহজে প্রবেশযোগ্য এবং সহযোগিতামূলক পরিবেশ প্রদান করে।
গবেষণার শেষে মাল্টি-ওমিক্স বিশ্লেষণের মাধ্যমে প্রাপ্ত ফলাফলগুলি পরীক্ষাগারে যাচাই করা হয়। এটি নিশ্চিত করে যে চিহ্নিত ডেটার মধ্যে সম্পর্কগুলি বাস্তব জীবনের পরিস্থিতিতেও কার্যকরী হচ্ছে। সাধারণত জৈবিক বৈধতা মূল্যায়নের জন্য এই পদ্ধতিগুলো ব্যবহৃত হয়:
- ইন-সিলিকো বৈধতা (in silico validation): মানুষের বাইরে অন্য প্রজাতির মধ্যে পরীক্ষা করে দেখা হয়, রোগ আক্রান্ত প্রাণীর মধ্যে গবেষণায় চিহ্নিত বায়োমার্কারগুলো (biomarker) উপস্থিত আছে কিনা।
- পরীক্ষামূলক বৈধতা (experimental validation): মানব কোষ-ভিত্তিক এবং স্তন্যপায়ী মডেলগুলিতে সিমুলেশন করে পরীক্ষা করা হয়।
- ক্লিনিকাল বৈধতা (clinical validation): মানব রোগীর নমুনাগুলিতে বায়োমার্কারগুলি রয়েছে কিনা, সেটাও পরীক্ষা করা হয়।
মাল্টি-ওমিক্স-এর প্রতিশ্রুতি
মাল্টি-ওমিক্স প্রযুক্তির ভবিষ্যৎ উজ্জ্বল। মাল্টি-ওমিক্স গবেষণা অদূর ভবিষ্যতে মৌলিক বিজ্ঞান এবং ফলিত শাখা উভয়ের জন্য নতুন সমাধান নিয়ে আসবে, এমনটা আশা করা হয়। যেমন এই ধরনের গবেষণায় নিম্নলিখিত প্রযুক্তিগত উন্নতি দেখা যেতে পারে:
- থ্রুপুট (throughput) বৃদ্ধি: প্রযুক্তির অগ্রগতির মাধ্যমে ডেটা সংগ্রহের গতি বাড়ানো সম্ভব হবে।
- মূল্য হ্রাস: মাল্টি-ওমিক্স প্রযুক্তির খরচ কমানো হলে এটি আরও বেশি গবেষকের কাছে পৌঁছাতে সক্ষম হবে।
- ডেটা অ্যাক্সেস (data access): অনলাইন আর্কাইভে মাল্টি-ওমিক ডেটাসেট সরবরাহ করলে গবেষকদের জন্য তথ্য প্রবেশাধিকার সহজ হবে।
মাল্টি-ওমিক্স কেবলমাত্র গবেষণার ক্ষেত্রেই নয়, বরং ক্লিনিক্যাল প্র্যাকটিসেও বিপ্লব ঘটাতে সক্ষম। কিছু সম্ভাবনা এখানে দেওয়া হলো:
- পারসোনালাইজড মেডিসিন (personalized medicine): মাল্টি-ওমিক্স পদ্ধতির মাধ্যমে রোগীদের ব্যক্তিগত জিনেটিক এবং মলিকিউলার প্রোফাইল (genetic and molecular profile) অনুযায়ী চিকিৎসা প্রদান করা সম্ভব হবে।
- নতুন থেরাপিউটিক টার্গেট (new therapeutic targets): বিভিন্ন ওমিক্স স্তরের তথ্য একত্রিত করে নতুন থেরাপিউটিক টার্গেট বা চিকিৎসার লক্ষ্যবস্তু চিহ্নিত করা হবে।
- রোগ পূর্বাভাস: মাল্টি-ওমিক্স বিশ্লেষণের মাধ্যমে রোগের পূর্বাভাস দেওয়া সম্ভব হবে, যা সময়মতো চিকিৎসা শুরু করতে সাহায্য করবে।
উপসংহার — শেষ হয়েও হলো না শেষ
মাল্টি-ওমিক্স একটি শক্তিশালী পদ্ধতি যা আমাদের জীববিজ্ঞানের জটিলতা বোঝার ক্ষেত্রে একটা বড়সড় বিপ্লব ঘটাচ্ছে। শুধু স্ট্রোক নয়, ক্যান্সার বা গিয়াঁ-বারে সিনড্রোম-এর (Guillain-Barré syndrome) মতো স্নায়ুর রোগের ক্ষেত্রেও এই পদ্ধতিগুলি ভবিষ্যদ্বাণী এবং আরোগ্যের নতুন পথ দেখাচ্ছে। মাল্টি-ওমিক্স গবেষণা একটি নতুন যুগের সূচনা করছে যেখানে আমরা রোগগুলোকে আরো গভীরভাবে বুঝতে শিখছি। এছাড়াও আরো নতুন ওমিক্স প্রযুক্তি উদ্ভাবিত হচ্ছে, যেমন একটি রোগাক্রান্ত ব্যক্তির মস্তিষ্কে সার্কিটগুলোর সংকলন — একে কনেক্টোমিক্স (connectomics) বলা হয়। এই নতুন নতুন ওমিক্সের উদ্ভাবন মাল্টি-ওমিক্স শাখাকে আরও সমৃদ্ধ করবে।
শুধু গবেষণা নয়, বর্তমান সময়ের প্রযুক্তিগত উন্নতি যথেষ্ট হলে মাল্টি-ওমিক্স-এর ব্যবহার আমাদের চিকিৎসা পদ্ধতিতেও বৈপ্লবিক পরিবর্তন আনতে সক্ষম। ভবিষ্যতে এই প্রযুক্তির মাধ্যমে আমরা আরও উন্নত এবং কার্যকর চিকিৎসা পদ্ধতি উদ্ভাবন করতে পারবো, যা মানব স্বাস্থ্যের উন্নতি সাধনে নিঃসন্দেহে গুরুত্বপূর্ণ ভূমিকা রাখবে।
উৎসাহী পাঠকদের জন্য
[1] ‘জেনেটিক টেস্টিং’ নিয়ে আরো জানতে এই মজার লেখাটি পড়তে পারো: জেনেটিক টেস্টিং-এর প্রতিশ্রুতি।
[2] জিন থেকে প্রোটিন সৃষ্টি নিয়ে আরো বিশদে জানতে এই লেখাটি পড়তে পারো: ব্যাকটেরিয়ায় জিনগত তথ্যের আদান-প্রদান।
[3] আমাদের দেহের পাচনতন্ত্রের মধ্যে ব্যাকটেরিয়ার ভূমিকা নিয়ে জানতে এই লেখাটি পড়তে পারো: মোটা হওয়া কি শুধুই খাদ্যনির্ভর।
[4] কনেক্টোমিক্স সার্বিক ধারণার জন্য একই লেখকের “কগনিটিভ কনেক্টোমিক্স এবং সোশিওমিক্সের মধ্যকার ক্রসরোড” শীর্ষক ইংরেজি প্রবন্ধটি পড়তে পারেন ।