সকালবেলা জলখাবার খেতে খেতে একবার চট করে ঘড়ির দিকে তাকিয়ে নিলো ফাতিমা। সময় ৮:৩৯, তাড়াতাড়ি সব সেরে বেরোতে হবে, নাহলে আবার অফিসে লেট! এদিকে মালতি এখনও এসে পৌঁছয়নি; সে না এলে ফাতিমা কি করে অফিস যাবে? মাকে তো আর একা রেখে যেতে পারবেনা। গত ৫ বছর ধরে তার মা শয্যাশায়ী, মালতিই তার মায়ের সমস্ত দেখাশোনা করে।
উপরের পরিস্থিতিটা হয়তো আমাদের অনেকেরই খুব চেনা। কিন্তু এখানে ফাতিমার মা যে রোগে আক্রান্ত, সেইটা হয়তো খুব একটা চেনা নয়, রোগটার নাম হান্টিংটনস ডিসিস (Huntington’s disease)। এইটা অত্যন্ত বিরল জিনঘটিত রোগ, যা একটা বিশেষ জিন-এর ক্রমবিন্যাসের বদল বা mutation-এর কারণে হয়ে থাকে। এই mutation মানবদেহে উপস্থিত থাকলে ৩০-৪০ বা তারও বেশি বয়েসে গিয়ে রোগের লক্ষণগুলো, যেমন নানারকম স্নায়ুঘটিত সমস্যা ধীরে ধীরে প্রকাশ পেতে থাকে। রোগ বাড়তে বাড়তে মানুষ শয্যাশায়ী হয়ে যায়, এবং শেষে মারা যায়। দুঃখের বিষয় এই যে, mutation-টা উপস্থিত থাকলে এই রোগ অবধারিত!
আমাদের গল্পের ফাতিমাও জানে নিজের ভবিষ্যৎ। আর সেই কারণেই কোনোদিন সে তার নিজের পরিবার শুরু করার কথা ভাবেনি। কারণ তার সন্তান জন্মালে ৫০% সম্ভাবনা থাকবে যে তার সন্তানও রোগটি তার থেকেই পাবে।
কিন্তু এমন যদি কোনো উপায় থাকতো যে ভ্রূণের মধ্যেই ওই জিন-টাকে ঠিক করে দেওয়া যেত, তাহলে তো আর কোনো সমস্যাই থাকতোনা। কিন্তু এমনটাও কি সম্ভব!
জিন ‘ঠিক করা’ মানে কী?
এককোষী ব্যাক্টেরিয়াই হোক কিংবা মানুষ, সকলের কোষ তৈরির সব তথ্য DNA-তে সংরক্ষিত থাকে। অনেকটা ব্লু-প্রিন্ট বা নকশার মতো।
আসলে DNA দেখতে একটা ডাবল হেলিক্স, অর্থাৎ দুটো সমান্তরাল মস্ত লম্বা ফিতের মতো, যা কিনা ক্রোমোজোম নামক একটা গঠনের মধ্যে পেঁচিয়ে ঠাসা থাকে। DNA-এর চারখানা গঠনগত একক বা বেস থাকে, এদের নিউক্লিওটাইড বলে। এরা হলো A (adenine), T (thymidine), G (guanine), এবং C (cytosine)। DNA-এর মধ্যে এই নিউক্লিওটাইডগুলো বিভিন্ন ক্রমবিন্যাসে সাজানো থাকে (ছবি ১)। এই ক্রমবিন্যাসকেই DNA সিকোয়েন্স (sequence) বলে।
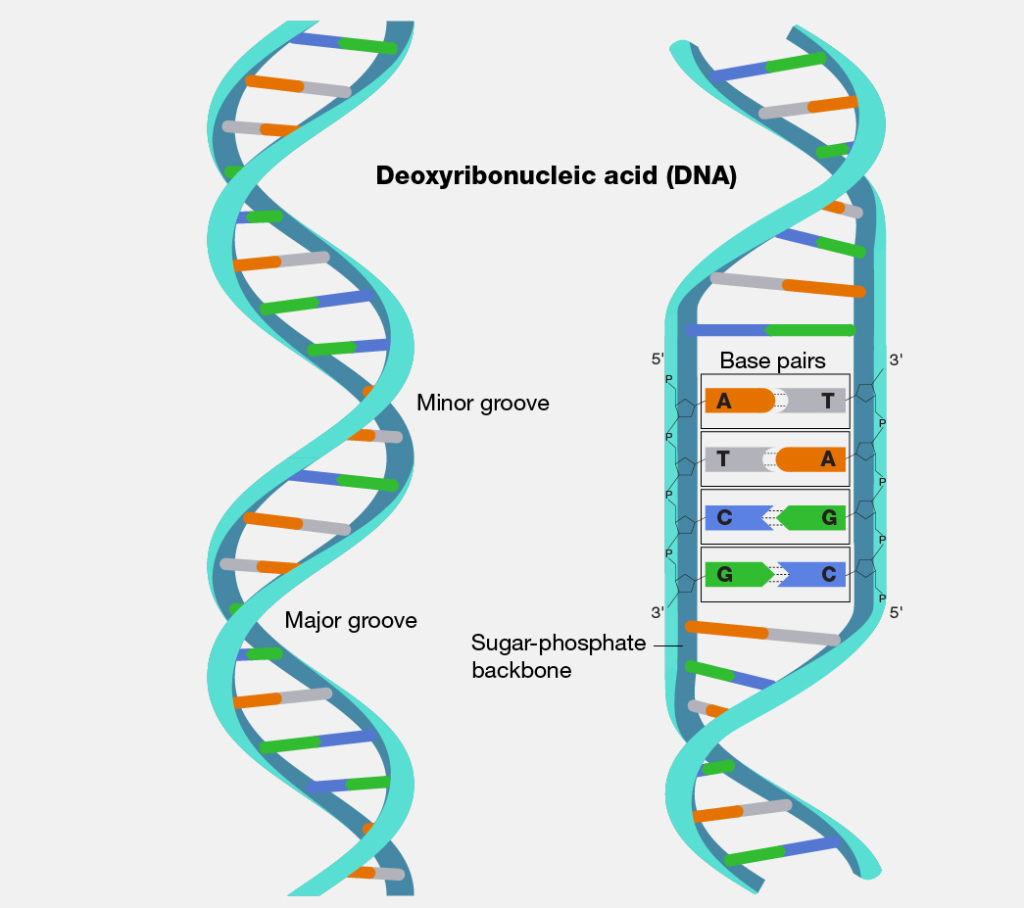
DNA-এর দুটো সমান্তরাল ফিতের নিউক্লিওটাইড এর মধ্যে জোড় বাঁধা থাকে, এবং কোন দুটো নিউক্লিওটাইড জোড় বাঁধবে সেটাও ঠিক করে দেওয়া আছে। A জোড় বাঁধে T এর সাথে, আবার G জোড় বাঁধে C এর সাথে। অর্থাৎ যেকোনো একটা ফিতের সিকোয়েন্স জানলেই অপরটারও সিকোয়েন্স জেনে ফেলা যায়।তাই DNA-র দুটো ফিতেকে একে ওপরের পরিপূরক ভাবা যেতে পারে।
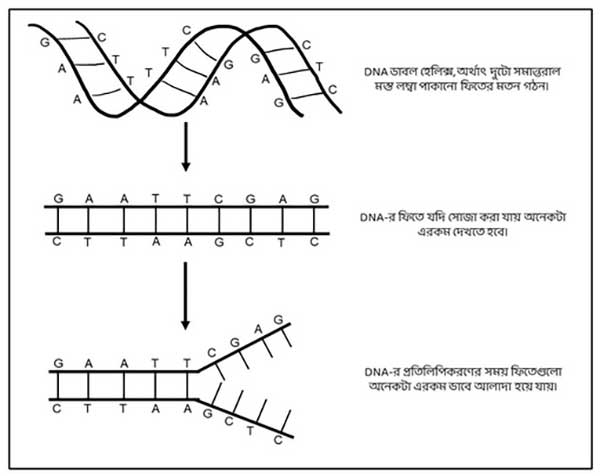
যখন কোষ বিভাজন হয় DNA-এরও প্রতিলিপি তৈরি হয়। DNA প্রতিলিপিকরণের সময় দুটো ফিতে একে অপরের থেকে আলাদা হয়, এবং এক একটা ফিতে ছাঁচ হিসেবে ব্যবহার করা হয় নতুন ফিতে তৈরি করার জন্য (ছবি ২)। এই বিষয়ে আরো বিস্তারিত জানতে এই লেখাটা দেখতে পারো।
এই DNA সিকোয়েন্স-এর কিছু নির্দিষ্ট অংশের মধ্যে প্রোটিন তৈরির তথ্য জমা থাকে, এই অংশকেই জিন বলে। অর্থাৎ প্রতিটা জিন-এর একটা নির্দিষ্ট নিউক্লিওটাইড সিকোয়েন্স থাকে। এই সিকোয়েন্সের কোথাও যদি ভুল থাকে তখনই বাঁধে গন্ডগোল; দেখা দেয় জিনঘটিত রোগ। জিন সিকোয়েন্সে ভুল কেন হয় সে আরেক মস্ত গল্প, সেই নিয়ে এখানে আর আলোচনা করছিনা। কোনোভাবে এই ভুল সিকোয়েন্সকে যদি ঠিক সিকোয়েন্স দিয়ে প্রতিস্থাপিত করা যায়, তাহলেই জিন ‘ঠিক করে’ দেওয়া সম্ভব হবে।
সম্ভাবনার আলো
২০১২ সালে মার্কিন বিজ্ঞানী জেনিফার ডাউডোনা এবং ফরাসী বিজ্ঞানী এমানুয়েল শার্পেন্টিয়ের-এর গবেষণাপত্র কিছুটা এই সম্ভাবনার কথাই বলেছিলো। এর জন্য তাঁদের ২০২০-তে রসায়নে নোবেল পুরস্কারও দেওয়া হয় [১]। তাঁরা একটি বিশেষ ব্যাক্টেরিয়ার কোষ-তন্ত্রের উপর গবেষণা করছিলেন, যার পোষাকি নাম CRISPR/Cas9 সিস্টেম। ব্যাক্টেরিয়া তাদের কোষের মধ্যে অনাক্রম্যতা বা ইমিউনিটি গড়ে তোলার জন্য এটা ব্যবহার করে, এবং বেশ কিছু ব্যাক্টেরিয়াতে এই সিস্টেম থাকে।
কিন্তু এই পদ্ধতি নিয়ে সেই ১৯৮৭ সাল থেকে বিজ্ঞানীরা কাজ করে আসছেন। তাহলে এই উপরোক্ত বিজ্ঞানীদ্বয় এত বছর পর কী এমন করলেন যে সেই নিয়ে ২০২০ সালে তাঁদের নোবেল পুরস্কার দেওয়া হলো?

জেনিফার ডাউডোনা এবং এমানুয়েল শার্পেন্টিয়ের তাঁদের গবেষণাপত্রে প্রথম দেখালেন যে এই CRISPR/Cas9 সিস্টেমকে কাজে লাগিয়ে বিজ্ঞানীরা নিজেদের প্রয়োজনমতন যে কোনো জিনকে বদলাতে বা এডিট করতে পারেন [১]। সেই সময়ে তাঁদের গবেষণাপত্র খুব একটা যে সাড়া ফেলেছিলো তা নয় [২]। কিন্তু তাঁদের কাজ যে কতটা যুগান্তকারী তা গত দশ বছরে এই বিষয়ের গবেষণা এবং বিভিন্ন ক্ষেত্রে এর প্রয়োগ দেখলে সহজেই অনুমান করা যায়।
তবে মানুষের কথা পরে, এই CRISPR/Cas9 সিস্টেম কিন্তু ব্যাকটেরিয়া-র নিজেরই কাজে লাগে। কাজে লাগে আত্মরক্ষার জন্য।
ব্যাকটেরিয়া বনাম ভাইরাস
CRISPR/Cas9 আসলে কী? ব্যাক্টেরিয়ার DNA-তে কিছু বিশেষ সিকোয়েন্স-এর পুনরাবৃত্তি দেখা যায় যাকে CRISPR বলে (clustered regularly interspaced short palindromic repeats)। এই সিকোয়েন্স-এর পুনরাবৃত্তির মাঝে মাঝে এমন সিকোয়েন্স থাকে যেগুলো আদৌ ব্যাকটেরিয়া-র নিজের DNA-র নয়। এগুলো আসে ভাইরাস থেকে।
ঠিক তাই, ব্যাক্টেরিয়ারাও ভাইরাস দ্বারা আক্রান্ত হয়, এবং তাদের হাত থেকে বাঁচার জন্যই এই আয়োজন। এই মাঝের সিকোয়েন্সগুলোকে বলে spacer। কোনো ভাইরাস যখন ব্যাকটেরিয়াকে আক্রমণ করে, তখন সেই ভাইরাস এর DNA-এর কিছু সিকোয়েন্স ওই CRISPR সিকোয়েন্সের মাঝে মাঝে ঢুকে যায়, হয়ে যায় spacer সিকোয়েন্স (ছবি ৩)। পুলিশের খাতায় নাম উঠে যাওয়ার মতন আর কি, ‘মোস্ট ওয়ান্টেড’। এই প্রক্রিয়ার সাহায্যে ব্যাক্টেরিয়া তার শত্রু ভাইরাসকে মনে রেখে দেয় এবং ভবিষ্যতে কোনো আক্রমণ থেকে নিজেকে রক্ষা করে [১]।
শুধু তাই নয়, এই ব্যাক্টেরিয়ার কোষ থেকে যে পরবর্তী প্রজন্ম তৈরি হবে, তার মধ্যেও এই তথ্য চালান করে দেয়। ব্যাপারটা আমাদের ভ্যাকসিন নেওয়ার সাথে তুলনা করা যেতে পারে। ভ্যাকসিন যেমন আমাদের শরীরের ইমিউন সিস্টেমকে ট্রেনিং দিয়ে দেয় ভবিষ্যৎ আক্রমণের সাথে লড়াই করার জন্য, অনেকটা সেরকমই।
CRISPR সিকোয়েন্স কিভাবে ভাইরাস এর থেকে রক্ষা করে এবং সেই রক্ষা করার পিছনে Cas9-এর ভূমিকা কী, সেটা কয়েকটা ধাপে বোঝানো হলো।
প্রথম ধাপ: ভাইরাস ডিএনএ-র অনুপ্রবেশ
প্রথমে যেটা হয়, সেটা আগেই বলা হলো: ভাইরাস-এর ডিএনএ ঢুকে যায় ব্যাকটেরিয়া-র ডিএনএ-র মধ্যে।
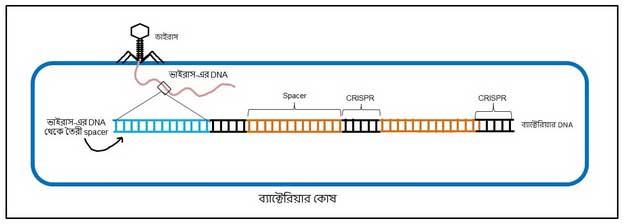
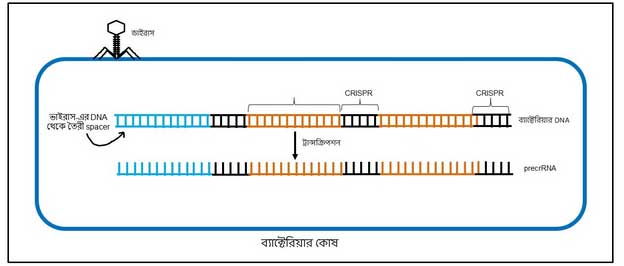
দ্বিতীয় ধাপ: ডিএনএ থেকে আরএনএ সৃষ্টি
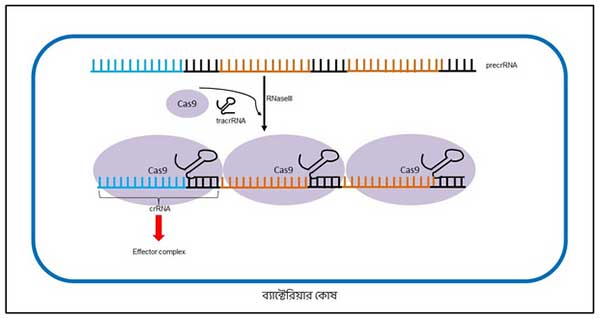
আণবিক জীববিদ্যার নিয়ম অনুযায়ী DNA থেকে RNA তৈরি হয়। সেটা এই spacer এবং CRISPR সিকোয়েন্স-এর ক্ষেত্রেও হয় (কিভাবে DNA থেকে RNA তৈরি হয় সেই বিষয়ে জানতে এই লেখাটা দেখতে পারো)। এই RNA-কে বলে precrRNA (ছবি ৪)।
precrRNA-র মধ্যে কিন্তু ভাইরাস-এর সিকোয়েন্সগুলো পরোক্ষভাবে এসে যায়। কারণ precrRNA-এর ওই spacer অংশগুলো আসলে ভাইরাস-এর DNA-র পরিপূরক। তাই, precrRNA-এর সিকোয়েন্স শত্রু ভাইরাসের ডিএনএ সিকোয়েন্স দেখলেই তার সাথে জোড় বাঁধতে পারে। কিন্তু জোড় বেঁধে লাভ কী?
তৃতীয় ধাপ: আরএনএ-র সাথে Cas9 উৎসেচকের বন্ধন
ভাইরাস-এর সাথে জোড় বেঁধে লাভ কী, সেটা বলার আগে এই CRISPR/Cas9 সিস্টেম-এর দ্বিতীয় অংশ, Cas9-এর কথা বলা যাক।
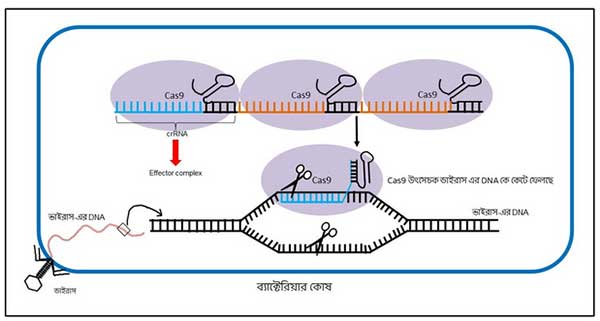
Cas9 আসলে একটা উৎসেচক; এর বিশেষ ক্ষমতা আছে DNA-কে কেটে ফেলার [১]। এই Cas9 এবং আরো বেশ কিছু সহায়ক মিলে precrRNA থেকে কাটছাঁট করে crRNA তৈরি করে (ছবি ৫)। এই crRNA এবং উৎসেচকগুলোকে একসাথে এফেক্টের কমপ্লেক্স (effector complex) বলে (ছবি ৫)। এই এফেক্টের কমপ্লেক্স-এর সাহায্যেই ব্যাকটেরিয়া ভবিষ্যতে ভাইরাসের আক্রমণ থেকে রক্ষা পায়।
চতুর্থ ধাপ: পরবর্তী ভাইরাস-এর আক্রমণ
এইবার ভাইরাস আক্রমণ করলে, এই এফেক্টের কমপ্লেক্সে থাকা crRNA সেই ভাইরাস-এর DNA পর্যন্ত Cas9 উৎসেচককে পথ দেখিয়ে নিয়ে যায়, অনেকটা গাইড-এর মতন, এবং ভাইরাস-এর DNA-তে আটকে যায়। মানে ‘মোস্ট ওয়ান্টেড’-কে খুঁজে বের করে চিনিয়ে দিলো আর কি। এইবার Cas9 ভাইরাস-এর DNA-কে করে দেয় ঘ্যাচাংফু (ছবি ৬)। ব্যাস, ভাইরাস হয় কুপোকাত।
জিন এডিটিং-এর হিড়িক
ডাউডোনা এবং শার্পেন্টিয়ের দেখলেন এই CRISPR সিকোয়েন্সের মাঝে spacer-এ যদি এমন কোনো জিন-এর সিকোয়েন্স ঢুকিয়ে দেওয়া যায় যা মানব দেহের কোনো জিন-এর অংশ, তাহলেই কেল্লা ফতে! CRISPR/Cas9 এর সাহায্যে সেই অংশকেও কেটে বাদ দিয়ে দেওয়া যাবে। এর ফলে mutation বহনকারী অর্থাৎ গলদ জিনকে সহজেই সংশোধন করা সম্ভব হবে।
এটা অনেকটা কম্পিউটারে টাইপ করার মতন। কিছু একটা ভুল টাইপ হয়ে গেলে যেমন আমরা সেই অংশটা মুছে আবার ঠিক করে লিখি, অনেকটা সেরকম। এটা সম্ভব হলে জিনঘটিত রোগ (যেমন আমাদের শুরুর গল্পের হান্টিংটন রোগ), ক্যান্সার এবং নানারকম বিরল রোগব্যাধির চিকিৎসায় যে যুগান্তকারী প্রভাব হবে তা বলাই বাহুল্য। CRISPR/Cas9 কিভাবে কাজ করে আরো বিশদে জানতে ৮ নম্বর তথ্যসূত্রে দেওয়া ভিডিওটা দেখতে পারো।
ডাউডোনা এবং শার্পেন্টিয়ের-এর এই কাজের পর, সারা পৃথিবীর বিজ্ঞানীরা এই বিষয়ে গবেষণা করতে প্রায় উঠে পরে লাগলেন। CRISPR/Cas9 সিস্টেমকে আরো নির্ভুল কিভাবে করা যায়, শুধু জিন বাদ না দিয়ে কিভাবে ইচ্ছামতন নতুন সিকোয়েন্স জুড়ে দেওয়া যায়, অথবা শুধু মাত্র একটা নিউক্লিওটাইড পাল্টে দিয়ে কিভাবে জিন সংশোধন করা যায়, বিভিন্ন ল্যাবরেটরিতে শুধু এই নিয়েই গবেষণা হচ্ছে। এরই পোষাকী নাম ‘জিন থেরাপি। এইখানে বলে রাখা ভালো, CRISPR/Cas9-এর আগেও বিজ্ঞানীদের হাতে জিন এডিট করার উপায় জানা ছিল। কিন্তু সেগুলো CRISPR/Cas9-এর মতন এত নির্ভুল ও সহজে করা যায়না, এবং খরচও বেশি [৩]।
সাম্প্রতিক একটি রিপোর্টে জানা গেছে নিউজিল্যান্ড-এ একটা ড্রাগ ট্রায়াল অনুমোদন পেয়েছে। এই ড্রাগটা মূলত রোগীর দেহে একটা বিশেষ জিন-এর একটা নিউক্লিওটাইড-কে পাল্টে দেবে, যার ফলে তার কোলেস্টেরল মাত্রা কমবে এবং কমবে হৃদরোগের সম্ভাবনাও। ইতিমধ্যে একজন রোগীর দেহে ইনজেকশন দেওয়াও হয়েছে [৪]। এইরকমই আরো বিভিন্ন বিরল জিনঘটিত রোগ, স্নায়ুতন্ত্রের বিভিন্ন রোগ যেমন Alzheimer’s, Parkinson’s disease, এমনকি ক্যান্সার এর মতন মারণ রোগের চিকিৎসারও উপায় বিজ্ঞানীরা খুঁজছেন এই ‘জিন এডিটিং’ টেকনোলজি ব্যবহার করে। এর বেশিরভাগই এখনও গবেষণার স্তরে থাকলেও, অনেক জিন থেরাপি ক্লিনিকাল ট্রায়াল স্তরে পৌঁছে গেছে, এর মধ্যে উল্লেখযোগ্য হলো সিকল সেল অ্যানিমিয়ার জন্য জিন থেরাপি। আশা করা যায় অদূর ভবিষ্যতে এই সব ভয়ানক রোগ থেকে মানুষকে বাঁচানো সম্ভব হবে।
শুধু তাই নয়, যেসব বিজ্ঞানীরা মানুষের ক্রমবিকাশ বা developmental biology নিয়ে কাজ করছেন, তাঁরা অনেকেই জিন এডিটিং ব্যবহার করে কোনো বিশেষ জিন-এর একটা কোষের মধ্যে কী কাজ, সেটা কিভাবে কোষের বেড়ে ওঠায় বা রোগ সৃষ্টিতে সাহায্য করছে বা করছেনা তা বোঝার চেষ্টা করেন। আপাত ভাবে এই ধরণের গবেষণার তাৎক্ষণিক ফল বোঝা না গেলেও, এই ধরণের মৌলিক গবেষণার প্রভাব সুদূর প্রসারী। তার জলজ্যান্ত উদাহরণ CRISPR/Cas9 নিজেই। বিজ্ঞানীরা যদি বছরের পর বছর সামান্য ব্যাক্টেরিয়ার পিছনে সময় না দিতেন, আজকে আমরা এই CRISPR/Cas9-এর সীমাহীন সুযোগের কথা জানতেই পারতামনা।
তবে কি এইবার ‘ডিসাইনার বেবি’?
এতক্ষন যা আলোচনা করলাম, তার থেকে সহজেই অনুমান করা যায় যে এই পদ্ধতিতে মানব ভ্রূণে জিন এডিট করাও আর কোনো সাইন্স ফিক্শন নয়। ঠিক এই কাজটাই করে বসলেন চীন দেশের এক বিজ্ঞানী হি জিএনকুই এবং তার দল।
হিউমান ইমিউনো ডেফিসিয়েন্সি ভাইরাস অর্থাৎ HIV (যা AIDS রোগের জন্য দায়ী) একটা বিশেষ প্রোটিন CCR5 কে কাজে লাগিয়ে মানব কোষের মধ্যে প্রবেশ করে। বিজ্ঞানীরা দেখেছেন ১০% ইউরোপীয়ানদের মধ্যে এই জিন-এর একটা বিশেষ অংশ থাকেনা অর্থাৎ একটা deletion থাকে, এর ফলে সেইসমস্ত মানুষের দেহে HIV বাসা বাঁধতে পারেনা। হি, মানুষের ভ্রূণের ওই CCR5 জিন-এ পরীক্ষামূলকভাবে ওই বিশেষ অংশটি ছেঁটে ফেলেন জিন এডিট করে এবং ভ্রূণটা জরায়ুতে প্রতিস্থাপনও করে বসেন। হইচই বাঁধে ২০১৮ তে, যখন হি এক কনফারেন্সে প্রকাশ করেন যে তার প্রতিস্থাপন করা ভ্রূণ থেকে যমজ কন্যা জন্ম নিয়েছে। যেটা উনি চেপে গেছিলেন, সেটা হলে যে শিশু দুটো premature অবস্থায় জন্মেছিলো। এরপর হি-এর পরীক্ষা থেকে তৃতীয় একটি শিশুরও জন্ম হয় একই জিন-এ এডিট করার পর। এরপর যথারীতি সরকার থেকে তার গবেষণার কাজ বন্ধ করে দেওয়া হয় এবং তাঁকে তিন বছরের জন্য জেলে যেতে হয় [৫]।
এর আগে কি কেউ মানব ভ্রূণে জিন এডিট করতে চেষ্টা করেননি? অবশ্যই করেছেন। কিন্তু সেক্ষেত্রে হয় ভ্রূণটি এমন অবস্থায় ছিল যেখান থেকে কোনো মানব শিশু জন্মানো সম্ভব না বা সেই ভ্রূণকে কোনো ভাবেই জরায়ুতে প্রতিস্থাপন করার অভিপ্রায় নিয়ে বিজ্ঞানীরা পরীক্ষা করেননি [৫]।
খুব স্বাভাবিক ভাবেই এই ঘটনার পর সারা পৃথিবীতে বিজ্ঞানী মহলে শোরগোল পড়ে যায়। অনেকেই মনে করেন এই জাতীয় গবেষণা করার কিছু সর্বসম্মত নিয়মাবলী থাকা উচিত। এরপর ২০১৮ সালের ডিসেম্বর মাসে WHO একটা কমিটি গঠন করে ‘Expert Advisory Committee on Developing Global Standards for Governance and Oversight of Human Genome Editing’। এদের কাজই হলো মানুষের জিন এডিটিং নিয়ে যেসব গবেষণা চলছে তার বৈজ্ঞানিক, সামাজিক, নৈতিক, এবং আইনগত দিকগুলো খতিয়ে দেখা [৬]। বর্তমানে বেশিরভাগ দেশেই জিন এডিট করে ভ্রূণ জরায়ুতে প্রতিস্থাপন করা নিষেধ। কিন্তু গবেষণার জন্য বেশ কিছু দেশ মানব ভ্রূণে জিন এডিট করার অনুমতি দিয়েছে, এর মধ্যে ভারতও রয়েছে; অবশ্যই এই ভ্রূণগুলো কোনোভাবেই জরায়ুতে প্রতিস্থাপন করা যাবেনা [৭]।
ভ্রূণের জিন এডিট করলে অসুবিধে কোথায়?
যদিও CRISPR প্রযুক্তির সাহায্যে জিন এডিটিং আজ এক অসাধারণ জায়গায় পৌঁছে গেছে, তবুও বেশ কিছু ‘কিন্তু’ এখনও রয়েছে।
CRISPR-এ DNA কে কাটার জন্য যে উৎসেচক ব্যবহার করা হয় (Cas9) তা অনেক সময়ই লক্ষ্যভ্রষ্ট হয়। অর্থাৎ যে জিন-এ কাটার কথা ছিল, তার বদলে অন্য কোনো একটা জিন-এ গিয়ে কেটে ফেলে। অথবা ঠিকঠাক জায়গায় কাটলেও, পরের জোড়া লাগার ধাপটা, যেইটা কোষের নিজস্ব DNA মেরামত করার পদ্ধতির উপর নির্ভরশীল, সেটি অনেকসময়ই গড়বড়ে হয়। ফলে জোড়া লাগার কাজটাও নির্ভুল হয়না, এবং খারাপ জিন কেটে ফেলে ভালো হওয়ার বদলে ফল হয় উল্টো। একটা পরীক্ষায় দেখা গেছে যে, CRISPR দিয়ে জিন এডিট করা ভ্রূণের ১৬% এর মধ্যে এইধরণের অযাচিত প্রভাব দেখা যায় [৫]।
আবার ভ্রূণের জিন এডিট করার অন্য আরো সমস্যা রয়েছে। কেবল মাত্র এককোষী অবস্থায় থাকার সময় ভ্রূণের মধ্যে জিন-এ অদলবদল করা হলেও, জিন কাটছাঁট করার উৎসেচক (মানে Cas9) সঙ্গে সঙ্গে কাজ করতে শুরু করেনা, এবং ঠিক কোন সময়ে এটি জেগে উঠে কাজ করা শুরু করে সেটাও বিজ্ঞানীরা এখনো পুরোপুরি বুঝে উঠতে পারেননি। এর ফলে ভ্রূণের মধ্যে যখন কোষ বিভাজন শুরু হয়, অর্থাৎ বেড়ে উঠতে থাকে, তার মধ্যে কিছু কোষে হয়তো জিন অদলবদল হয়েছে, আর বাকি কোষগুলোতে হয়নি, এরকম একটা পরিস্থিতি তৈরি হয়–একে বলে mosaicism [৯]। যদিও বিজ্ঞানীরা জিন এডিট করার পর ভ্রূণের পরীক্ষা করে নেন। কিন্তু সেইটা করা হয় যখন ভ্রূণের বয়স ৫ দিন। এইসময় ভ্রূণে প্রায় ১০০টা কোষ থাকে; এর মধ্যে থেকে গোটা পাঁচেক কোষ নিয়ে পরীক্ষা করা হয় জিন এডিট ঠিক মতন হয়েছে কিনা দেখার জন্য। কিন্তু বুঝতেই পারছো, ৫টা কোষে ঠিক আছে মানেই যে বাকি কোষগুলোতেও ঠিক আছে, এমনটা একেবারেই নয় [৫, ৯]।
Mosaicism কিভাবে এড়ানো সম্ভব সেই নিয়ে বিজ্ঞানীরা নানান রকম পরীক্ষা নিরীক্ষা চালাচ্ছেন। ভবিষ্যতে হয়তো এর কোনো সুরাহা পাওয়া যাবে। কিন্তু এই আলোচনা থেকে একটা জিনিস স্পষ্ট, হি যে কাজটি করেছিলেন সেইটা অত্যন্ত অবিবেচনামূলক হয়েছিল। CRISPR প্রযুক্তি যতই এগিয়ে যাক, জিন এডিট করা শিশুর জন্ম দেওয়ার মতন জায়গায় এখনো পৌঁছয়নি। অনেক বিজ্ঞানীরাই মনে করেন শিশু জন্মানোর পরে এই পদ্ধতির সাহায্যে জিনঘটিত রোগ সরানোই যায়, যা কিনা তার থেকে আর পরবর্তী প্রজন্মে বাহিত হবেনা। কিন্তু এমন কোনো এডিট করা উচিত নয়, যা পরের প্রজন্মে বাহিত হবে। এর জন্য এখনো অনেক অনেক পরীক্ষার প্রয়োজন।
বর্তমানে আমরা জানিনা সেই তিনজন ‘ডিসাইনার বেবি’-রা কেমন আছে। খুব স্বাভাবিকভাবেই, তাদের পরিচিতি গোপন রাখা হয়েছে। তাদের কোনো শারীরিক অসুবিধে আছে কিনা, অথবা এখন সুস্থ থাকলেও ভবিষ্যতে যে কোনো রকম অসুবিধে হবেনা, তারই বা কি ভরসা আছে? তবে, আশা করা যায় আমাদের শুরুর গল্পের পরিস্থিতি হয়তো কোনো একদিন বদলাবে; জিনঘটিত রোগ হয়তো একদিন জন্মের পর সরানো সম্ভব হবে। কিন্তু ইচ্ছামতন জিন কাটছাঁট করে মানব শিশুর জন্ম দেওয়া এখনও আইনত দণ্ডনীয়।
তথ্যসূত্র :
[১] A Programmable Dual-RNA–Guided DNA Endonuclease in Adaptive Bacterial Immunity. DOI: 10.1126/science.1225829
https://www.science.org/doi/10.1126/science.1225829
[২] CRISPR, 10 Years On: Learning to Rewrite the Code of Life.
https://www.nytimes.com/2022/06/27/science/crispr-gene-editing-10-years.html
[৩] Genome-Editing Technologies: Concept, Pros, and Cons of Various Genome-Editing Techniques and Bioethical Concerns for Clinical Application.
[৪] Crispr for the Masses Gets a Little Closer to Reality. (https://www.washingtonpost.com/business/crispr-for-the-masses-gets-a-little-closer-to-reality/2022/07/13/6fa051d0-02aa-11ed-8beb-2b4e481b1500_story.html)
[৬] Human genome editing: recommendations. https://www.who.int/publications/i/item/9789240030381
[৭] Human Germline and Heritable Genome Editing: The Global Policy Landscape. DOI: 10.1089/crispr.2020.0082.
[৮] CRISPR-Cas9 Genome Editing Technology.
[৯] CRISPR babies: when will the world be ready? https://www.nature.com/articles/d41586-019-01906-z[

