পর্ব – ১
সন্ধ্যে ঘনিয়ে আসছে। চারিদিকে পাহাড় আর ঘন জঙ্গলের মাঝে গা কেমন যেন ছম-ছম করে উঠছে। গন্তব্যস্থান কাছের একটা গ্রাম, কিন্তু সেখানে পৌঁছতে গেলে সামনের বড় টিলা-টা আগে পেরোতে হবে। সমস্যা এই যে টিলা পেরোতে বেশ খানিক্ষণ সময় লাগবে এবং অন্ধকারে সেই দুর্গম রাস্তা চেনা যাবে না। পিছু হটাও মুশকিল,কারণ পেছনের গ্রাম বহু দূরে ফেলে আসা হয়েছে। এক জায়গায় দাঁড়িয়ে থাকলেও নির্ঘাত বন্য প্রাণীদের পেটে পড়তে হবে ! কি সাংঘাতিক বিপত্তি ! এই ভয়ংকর পরিস্থিতিতে সাথে কয়েকজন বন্দুক-ধারী দেহরক্ষক থাকলে ভালো হত না?
তোমরা কেউ কোনোদিন এই অবস্থার সম্মুখীন হয়েছো কিনা জানি না, কিন্তু আমাদের এবং বহু প্রাণীদের কোষের মধ্যে অনেক প্রোটিনের সর্বক্ষণ কিছুটা এইরকমই সমস্যার মুখোমুখি হতে হয় ! প্রোটিন কি জিনিস তা আমরা সবাই জানি – ডিম, মাংস আর নানান ধরনের খাবারে প্রোটিনের গুণগান কে না শুনেছে ! এও হয়ত জানা যে কোষের সবচেয়ে গুরুত্ত্বপূর্ণ কর্মী এই প্রোটিনই। তবে কিছু প্রোটিনকে আমাদের দেহের কোষের মধ্যে বাঁচতে যে সত্যি পর্বতপ্রমাণ সমস্যার মোকাবিলা করতে হয়, তা কি জানো? হাজার হাজার বছরের বিবর্তনের ফলে প্রকৃতি আমাদের মধ্যে সেই প্রোটিন সুরক্ষার যে অবিশ্বাস্য প্রযুক্তি তৈরী করেছে, আমি আজ এই লেখায় তার একটু বিবরণ দেব। প্রশ্ন নিশ্চয়ই জাগছে মনে যে প্রোটিনের সমস্যার সাথে পাহাড়ি জঙ্গলে পথ হারানোর সম্পর্ক কোথায়? বন্দুকধারী রক্ষকের উল্লেখই বা কেন করলাম? তাহলে আমি প্রোটিনের গল্প আগে একটু বলি।
প্রোটিনের ভাঁজ
“অ্যামিনো অ্যাসিড” (amino-acid) নামক একটা অণুকে শিকলের মত একটার পর একটা সাজিয়ে তৈরি করা যায় একটা প্রোটিন। মানুষের দেহে যে সব প্রোটিন থাকে সেখানে গড়ে চার-পাঁচশ অ্যামিনো অ্যাসিডের অণু থাকে। আর প্রকৃতিতে দু-তিন রকম না, কুড়ি রকমের অ্যামিনো অ্যাসিড রয়েছে। তাহলে আন্দাজ করতে পারছো নিশ্চয় , কি বিপুল সংখ্যক উপায়ে এই অ্যামিনো অ্যাসিডের মালা – বা প্রাথমিক সজ্জা (প্রাইমারী সিকোয়েন্স) তৈরি করা যায়? এই অ্যামিনো অ্যাসিডদের নাম সুবিধার জন্য সংক্ষিপ্ত করা হয়েছে: যেমন ধরো অ্যাস্পার্টিক অ্যাসিডকে ‘Asp’ বা একটা অক্ষর ‘D’ দিয়ে আমরা সাধারণত বোঝাই (নিচের ছবিগুলো দেখলেই বুঝতে পারবে) ।
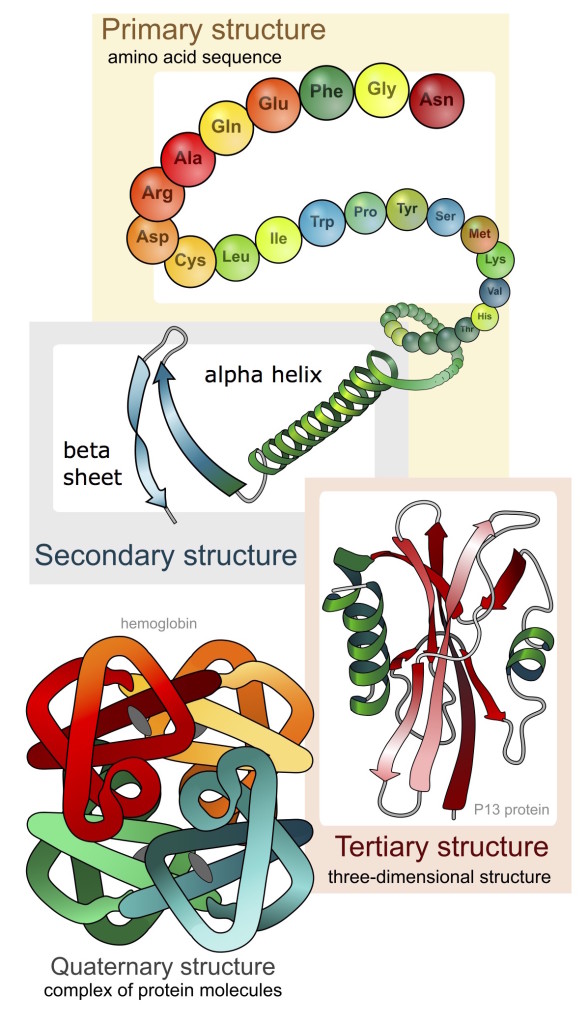
এ পর্যন্ত পড়ে তোমাদের মনে হতে পারে যে প্রোটিন একটা লম্বা (যদিও আণুবীক্ষণিক) সুতোর মত বস্তু। আর সেরকম ভাবাটা খুব ভুলও নয়, কারণ বৈজ্ঞানিকেরা মনে করেন যে একটা প্রোটিন যখন কোষের মধ্যে প্রথম তৈরি হয়, তখন হয়ত কিছুটা সুতোর মতই চেহারা নিয়ে সে জন্মায়। কিন্তু তৈরি হওয়ার মুহূর্তের মধ্যেই একটা বিস্ময়কর ঘটনা ঘটে, যেটার মূলেই হচ্ছে আমাদের আজকের গল্প। লম্বা সুতোর মত প্রোটিনটা চতুর্দিকের জলের ধাক্কা খেয়ে খুব নিখুঁত ভাবে গুটোতে থাকে। এর ফলে প্রোটিনের চেহারাও জটিল হতে থাকে, আর সুতোর মত প্রাথমিক সজ্জাতেই আটকে থাকে না । তৈরি হয় সেকেন্ডারী সজ্জা। তারপর জটিলতর হয়ে দেখা দেয় টার্শিয়ারী সজ্জাও। পাশের ছবিটা দেখলে সহজেই বুঝতে পারবে এই সব সজ্জার জটিলতা। এইভাবে এক সময় এই প্রক্রিয়ার সমাপ্তি ঘটে এবং প্রোটিনটি তার স্বাভাবিক ত্রিমাত্রিক রূপ বা ‘নেটিভ স্টেট’ পায় (প্রচ্ছদের ছবি আর এই প্রক্রিয়াটির একটা ভিডিও এখানে১ দেখলে ব্যাপারটা পরিষ্কার হবে কিছুটা) । বৈজ্ঞানিকেরা মনে করেন কেবল মাত্র এই নেটিভ স্টেটেই একটা প্রোটিন তার নির্দিষ্ট কাজ কর্ম করতে সক্ষম হয়।
আমি জানি তোমাদের মনে হতে পারে যে আমি এতে নতুন কি বললাম? বাড়িতে এটা তো আমাদের রোজকার অভিজ্ঞতা — একটা সুতোর গোছা নাড়াচাড়া করলেই তো নানান রকম জট ও প্যাঁচ পড়তে শুরু করে! আচ্ছা একটা এক্সপেরিমেন্ট করা যাক তবে — একখানা সুতো নিয়ে এলোপাথাড়ি ভাবে ভাঁজ করতে থাকো । হয়ে গেলে ছবি তুলে রাখো তার । এবার অন্য একটা একইরকম সুতো নিয়ে আবার চেষ্টা করো তো দেখি ওই একই গঠন তৈরি করতে ! প্রোটিনের ক্ষেত্রে অদ্ভুত জিনিস কি জানো? জলের অণুর এলোপাথাড়ি ধাক্কা খেয়েও প্রোটিন কিন্তু এই কাজটা করতে প্রায় প্রতিবারই সক্ষম হয় ! প্রোটিনের ভাঁজ করা এই গঠনই হলো তার নেটিভ স্টেট । তোমরা কি সুতোর গোছা দিয়ে বারবার অনুরূপ প্যাঁচ তৈরি করতে পারবে? পারবে কি প্রোটিনের মত নানান সেকেন্ডারি স্ট্রাকচার তৈরি করতে?
একটা প্রোটিন কেবলমাত্র তার ভাঁজ করা ‘নেটিভ স্টেটেই’ নির্দিষ্ট কাজ কর্ম করতে সক্ষম হয়।
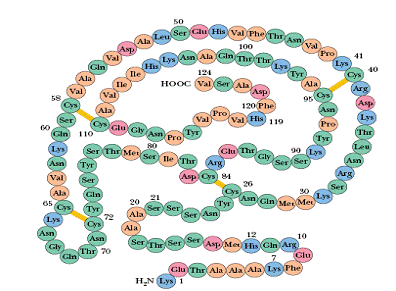
প্রোটিনদের এই অদ্ভুত ক্ষমতার পরিচয় প্রথম পাওয়া যায় খ্রীষ্টান আন্ফিন্সেনের (Christian Anfinsen) ১৯৫০-১৯৬০ দশকের এক যুগান্তকারী গবেষণায়২। তিনি ও তাঁর সহকর্মীরা দেখালেন, শরীরের বাইরে টেস্ট-টিউবেও রাইবোনিউক্লিয়েস নামের এক প্রোটিন লম্বা সুতো অবস্থা থেকে নেটিভ স্টেট-এ পৌঁছতে পারে। এর থেকে অনুমান করা গেল যে একটা প্রোটিনের শেষের চেহারা নিয়ন্ত্রণ করে কেবল মাত্র তার শুরুর প্রাইমারি সিকুএনস। আন্ফিন্সেন এও প্রস্তাব করলেন যে নেটিভ স্টেট হচ্ছে অনন্য; একটা নির্দিষ্ট প্রোটিন যতবার সুতো অবস্থা থেকে ভাঁজ করবে, ততবার নেটিভ স্টেটের গঠন একদম একই হবে (uniqueness of native state)৩,৪। ১৯৭২ সালে আন্ফিন্সেন নোবেল পুরস্কার পেলেন এবং স্থাপিত হয়ে গেল “আন্ফিন্সেনের ডগমা” বা মতবাদ, বৈজ্ঞানিক জগত থেকে স্কুল কলেজের পাঠ্য পুস্তকে৫।
নানান প্রোটিনের জটলা ও দেহরক্ষী বাহিনী
তোমাদের হয়ত আগের অনুচ্ছেদটা পড়ে মনে প্রশ্ন জাগতে পারে যে – আন্ফিন্সেন তো পরীক্ষা করেছেন কিছু বিশেষ প্রোটিনের ওপর – বাদবাকি প্রোটিনও যে একদম একই রকম ভাবে ভাজ হতে সক্ষম হবে, তার কি প্রমাণ আছে? কোষের মধ্যে আর টেস্ট টিউবে কি কোনো পার্থক্য থাকতে পারে না? ১৯৭০-এর দশকের পর থেকে আমাদের ভাবনা চিন্তা কিঞ্চিৎ পাল্টে গেছে। যদিও আন্ফিন্সেনের ডগমা অনেক প্রোটিনের ক্ষেত্রে কাজ করে, কিছু ভীষণ গুরুত্বপূর্ণ প্রোটিন-এর ক্ষেত্রে সেই নিয়ম পুরোপুরি খাটে না এবং সেই সব প্রোটিনদের গল্পই হচ্ছে আমাদের পাহাড়ি জঙ্গলে আটকে পড়ার গল্প।
১৯৭০-এর কয়েক বছর পর থেকেই বোঝা যেতে লাগল যে কোষের মধ্যে বেশ কিছু জটিলতা আছে যা আন্ফিন্সেন বর্ণনা করেন নি। কোষের মধ্যে নানান প্রোটিনের ভিড়ে কিছু প্রোটিন তাদের নেটিভ স্টেটে পৌঁছতে পারে না। সুতো অবস্থা থেকে নেটিভ স্টেটে যাওয়ার পথে তারা ‘রাস্তা’ ভুল করে বেমানান সব জটে আর প্যাঁচে আটকে যায়। এই সমস্ত ভুল ভাবে জড়ানো প্যাঁচানো প্রোটিনের গঠন কে বলে মিস-ফোল্ডেড স্টেট (misfolded state)। এই সব প্রোটিন যদি অফুরন্ত সময় পেত, তাহলে তারা জলের ধাক্কার সাহায্যে নিজেরাই জট ছাড়িয়ে অবশেষে নেটিভ স্টেটে পৌঁছতে পারত; কিন্তু শুরুর গল্পে যেমন টিলা পেরোবার সময় নেই, এই প্রোটিনদেরও দুর্ভাগ্যবশত হাতে সময়ের অভাব ! খুব দ্রুত এই সব ভুল জট ছাড়াতে না পারলে একটা বিচ্ছিরি ঘটনা ঘটতে আরম্ভ হয় – একটা মিস-ফোল্ডেড প্রোটিন কোষের মধ্যে ভিড়ভাট্টাতে নিজের মত অন্য মিস-ফোল্ডেড প্রোটিনদের সাথে জড়িয়ে যেতে শুরু করে! কি ভয়ানক কাণ্ড ভেবে দেখো তো দেখি একবার – নিজের নেটিভ স্টেটে না পৌঁছে সব মিস-ফোল্ডেড প্রোটিন একে অপরের সাথে জড়িয়ে যায় অপরিবর্তনীয়ভাবে ! আর আগেই বলেছি, নেটিভ স্টেটে না পৌঁছতে পারলে প্রোটিন একদম অকেজো ; এমনকি এও মনে করা হয় যে নানান কঠিন রোগের উৎপত্তি এই দলা পাকানো মিস-ফোল্ডেড প্রোটিনের থেকেই হয় । কোস্টা জিয়র্জপৌলস (Costa Georgopoulos), জন এল্লিস (John Ellis), জর্জ লরিমর (George Lorimer), আর্থার হরউইচ (Arthur Horwich) এবং ফ্রান্জ হার্টল (Franz Hartl) দের মত বৈজ্ঞানিকের কাজ থেকে এই তথ্যগুলি ক্রমশ প্রতিষ্ঠিত হয়েছে৬।
ভুল ভাবে জড়ানো প্যাঁচানো প্রোটিনের জট ছাড়াতে প্রয়োজন ‘মলিকুলার শ্যাপেরন’-দের।
তাহলে কোষের মধ্যে এই সব প্রোটিনদের উপায় কি? এইখানেই আশ্চর্য হতে হয় প্রকৃতির সৃজনশীলতা উপলব্ধি করে। বহু বছরের বিবর্তন তৈরি করেছে এক শ্রেণীর দেহরক্ষী, যারা প্রোটিনদের মিস-ফোল্ডেড স্টেট থেকে রক্ষা করে। এই দেহরক্ষীর দলও এক ধরনের প্রোটিন এবং এদের নাম “মলিকুলার শ্যাপেরন” (Molecular Chaperone)। তাদের অনুপস্থিতিতে মিস-ফোল্ডিং-এর ফাঁদে পড়া প্রোটিনরা ফাঁদেই পড়ে থাকত — সময় মত নেটিভ স্টেটে পৌঁছবার কোনো আশা থাকত না ! মানুষের কোষের চেয়ে একটা ব্যাকটেরিয়ার কোষের জটিলতা কম বলে অনেক বেশি পরীক্ষা নিরীক্ষা করা সম্ভব হয়েছে ব্যাকটেরিয়াদের শ্যাপেরনের ওপর৭। সেই সব গবেষণা থেকে বিজ্ঞানীরা দেখেছেন যে সাধারণত যেসব ব্যাকটেরিয়াদের মারা খুব কঠিন, তাদের শুধু শ্যাপেরন অণু নষ্ট করলেই তারা সহজে মরে যায় !
পাঠকের মনে এখন প্রচুর প্রশ্ন জাগা স্বাভাবিক :
(১) প্রোটিন এবং আমাদের সেলাই করার সুতোর মধ্যে পার্থক্য কোথায়? কি ভাবে একটা প্রোটিন এরকম আশ্চর্যজনক ভাবে ভাঁজ করে ?
(২) এই শ্যাপেরনরা মিস্ফল্ডেড প্রোটিনদের বাঁচাচ্ছে বটে, কিন্তু এই কাজটা তারা হাসিল করছে ঠিক কি ভাবে?
(৩) গল্পের শুরুতে পাহাড়ি জঙ্গলে আটকে পড়ার কথাটা কি আমি শুধুই মজার উপমা হিসেবে ব্যবহার করেছি ? নাকি তার পেছনে কোনো বৈজ্ঞানিক কারণ রয়েছে ?
(৪) বেশিরভাগ প্রোটিনই যদি আন্ফিন্সেনের নিয়মমাফিক কাজ করে, তাহলে কিছু প্রোটিন কেন এরকম বেপরোয়া; কেন তারা নিজেরাই লক্ষ্মী ছেলের মত গুটিয়ে গিয়ে নেটিভ স্টেটে পৌঁছয় না?
(৫) একটা প্রোটিনের নেটিভ স্টেট কি আন্ফিন্সেনের দাবীর মত সত্যি অনন্য, নাকি সেই নেটিভ স্টেটেও নানান রকম গঠন থাকতে পারে?
এই সব প্রশ্নের জবাব পেতে গেলে আমাদের বুঝতে হবে প্রোটিন-পদার্থবিদ্যার কিছু মজার গল্প। আজকের জন্য এইটুকুই, সেই গল্প তোলা থাক না হয় পরের বারের জন্য!
-চলবে
লেখার উৎস ও অন্যান্য টুকিটাকি :
[১] ভিডিওটি তৈরি করা হয়েছে কম্পিউটারে, ‘coarse-grained molecular dynamics’ পদ্ধতি ব্যবহার করে। এই পদ্ধতিতে প্রত্যেকটা অ্যামিনো অ্যাসিডের ওপর অন্য সব অ্যামিনো অ্যাসিড এবং আসে পাশে জলের বল অঙ্কের মাধ্যমে গণনা করা হয়। এরপর গণনা করা হয় এই সব বলের ফলে প্রোটিনটার প্রত্যেকটা অ্যামিনো অ্যাসিড কি ভাবে নড়বে এবং এই গণনা করে বার করা যায় প্রোটিন সুতো থেকে নেটিভ স্টেটে কি ভাবে পৌঁছতে পারে।
[২] https://profiles.nlm.nih.gov/ps/access/KKBBLT.pdf
[৩] এই রাইবোনিউক্লিয়েস প্রোটিনে ‘ডাইসাল্ফাইড’ নামের কিছু বিশেষ ধরনের রাসায়নিক বন্ধন (chemical bond) থাকে, যা তাত্ত্বিকভাবে ১০৫ রকম ভাবে উপস্থিত থাকতে পারে — কিন্তু আন্ফিন্সেনরা দেখালেন যে নেটিভ স্টেট-এ এই প্রোটিনে কেবল মাত্র এক ভাবেই ডাইসাল্ফাইড বন্ধন তৈরি হয় ! রাইবোনিউক্লিয়েসের ছবিতে হলুদ লাইন দিয়ে দেখানো হয়েছে নেটিভ স্টেটের ডাইসাল্ফাইড বন্ধন। কিছু রাসায়নিকের কারসাজির সাহায্যে যদি অন্য ভাবে ডাইসাল্ফাইড বন্ধন তৈরি হয়, তাহলে রাইবোনিউক্লিয়েস প্রোটিন তার নেটিভ স্টেটে পৌঁছতে পারে না — নিজের নির্দিষ্ট কাজ করতে সক্ষম হয় না। এর থেকে আন্ফিন্সেনরা অনুমান করলেন যে নেটিভ স্টেটের সজ্জা হচ্ছে অনন্য (uniqueness of native state)
[৪] https://web.iitd.ac.in/~amittal/1973_Anfinsen_Science.pdf
[৫]আন্ফিন্সেনের নোবেল পুরস্কারের বক্তৃতা পড়ুন এখানে: https://www.nobelprize.org/nobel_prizes/chemistry/laureates/1972/anfinsen-lecture.pdf
[৬] জর্জ লরিমরের লেখা শ্যাপেরনের ঐতিহাসিক আখ্যান